题目内容
7. 氨气是一种重要工业原料,在工农业生产中具有重要的应用.
氨气是一种重要工业原料,在工农业生产中具有重要的应用.(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905kJ•mol-1
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1
则N2(g)+3H2(g)═2NH3(g)的△H=-92.4kJ/mol.
(2)工业合成氨气的反应为N2(g)+3H2(g)?2NH3(g).在一定温度下,将一定量的N2和H2通入到体积为1L的密闭容器中达到平衡后.改变下列条件,能使平衡向正反应方向移动且平衡常数不变的是①②.
①增大压强 ②增大反应物的浓度 ③使用催化剂 ④降低温度
(3)①实验室常用加热氯化铵固体和氢氧化钙固体的混合物来制取氨气,实验室还可在NaOH(填一种试剂)中滴加浓氨水的方法快速制取少量氨气.
②常温下氨气极易溶于水,溶液可以导电.氨水中水电离出的c(OH-)< 10-7 mol•L-1(填写“>”、“<”或“=”);
③将相同体积、pH之和为14的氨水和盐酸混合后,溶液中离子浓度由大到小的顺序为c(NH4+)>c(Cl-)>c(OH-)>c(H+).
(4)合成氨的原料氢气是一种新型的绿色能源,具有广阔的发展前景.现用氢氧燃料电池进行图所示实验:(其中a、b均为碳棒).如图所示:
右边Cu电极反应式是Cu-2e-=Cu2+.
a电极的电极反应式O2+2H2O+4e-=4OH-.
分析 (1)根据盖斯定律来计算化学反应的焓变即可;
(2)平衡常数只与温度有关,催化剂不能改变平衡状态,根据影响化学平衡移动的因素以及影响化学平衡常数的因素来回答;
(3)①NaOH和浓氨水也可以制取氨气;
②酸或碱抑制水电离;
③氨水可以和盐酸之间发生反应得到氯化铵溶液,根据离子浓度大小比较方法来回答;
(4)左边装置是燃料电池,通入氢气的电极是负极、通入氧气的电极是正极,右边装置在电解池,左边Cu是阴极、右边Cu是阳极,阳极上Cu失电子发生氧化反应;通入氧气的电极上氧气得电子和水反应生成氢氧根离子.
解答 解:(1)已知:①N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1
②4NH3(g)+5O2(g)═4NO(g)+6H2O(g)△H=-905kJ•mol-1
③2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1
则反应N2(g)+3H2(g)═2NH3(g)可以是①+③×$\frac{3}{2}$-②×$\frac{1}{2}$得到,
所以该反应的△H=180.5kJ•mol-1+(-483.6kJ•mol-1)×$\frac{3}{2}$-(-905kJ•mol-1)×$\frac{1}{2}$=-92.4kJ/mol,
故答案为:-92.4kJ/mol;
(2)平衡常数只与温度有关,催化剂不能改变平衡状态,增大反应物浓度化学平衡正向移动,增大压强,化学平衡向着气体系数和减小的方向移动,故答案为:①②;
(3)①NaOH溶解放出热量,一水合氨分解吸收热量,所以加入NaOH溶解后氢氧根离子浓度增大,抑制氨气溶解,则能生成氨气,故答案为:氢氧化钠固体;
②酸或碱抑制水电离,一水合氨电离出氢氧根离子而抑制水电离,所以水电离出的c(OH-)<10-7 mol•L-1,故答案为:<;
③将相同体积、pH之和为14的氨水和盐酸混合后,所得的溶液是氯化铵和氨水的混合物,溶液中离子浓度由大到小的顺序为c(NH4+)>c(Cl-)>c(OH-)>c(H+),故答案为:c(NH4+)>c(Cl-)>c(OH-)>c(H+);
(4)左边装置是燃料电池,通入氢气的电极是负极、通入氧气的电极是正极,右边装置在电解池,左边Cu是阴极、右边Cu是阳极,阳极上Cu失电子发生氧化反应,电极反应式为Cu-2e-=Cu2+;通入氧气的电极上氧气得电子和水反应生成氢氧根离子,电极反应式为O2+2H2O+4e-=4OH-,
故答案为:Cu-2e-=Cu2+;O2+2H2O+4e-=4OH-.
点评 本题考查较综合,涉及原电池原理、离子浓度大小比较、盖斯定律、化学平衡状态判断等知识点,为高频考点,难点是电极反应式的书写,要结合电解质溶液酸碱性书写;注意化学平衡状态判断方法,题目难度不大.

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案| A. | 红热的铁与水蒸气反应可生成氧化铁和氢气 | |
| B. | 将二氧化硫通入到紫色石蕊溶液中,溶液先变红后褪色 | |
| C. | 加热时,可将试管、蒸发皿、坩埚直接在酒精灯焰上加热 | |
| D. | 称量氢氧化钠固体时,应将氢氧化钠固体放在称量纸上称量 |
| A. | 芳香烃就是指苯和苯的同系物 | |
| B. | 通常可从煤焦油中或石油的催化重整来获取芳香烃 | |
| C. | 乙苯分子中所有原子可以处于同一平面上 | |
| D. | 苯和甲苯只能发生取代反应不能发生氧化反应 |
| 容器 | 甲 | 乙 |
| 反应物投入量 | 1mol N2、3mol H2 | 4mol NH3 |
| NH3的浓度(mol•L-1) | c1 | c2 |
| 反应的能量变化 | 放出a kJ | 吸收b kJ |
| 气体密度 | ρ1 | ρ2 |
| 反应物转化率 | α1 | α2 |
| A. | c1<c2<2c1 | B. | a+b>92.4 | C. | α1+α 2=1 | D. | ρ2=3ρ1 |
| A. | $\frac{3n}{2a}$ mol/L | B. | $\frac{2n}{3a}$ mol/L | C. | $\frac{2n}{a}$mol/L | D. | $\frac{3n}{a}$mol/L |
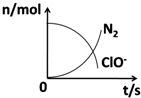 在一个氧化还原反应的体系中,共有H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
在一个氧化还原反应的体系中,共有H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )| A. | 还原剂是含CN-的物质,氧化产物只有N2 | |
| B. | 氧化剂是ClO-,还原产物是HCO3- | |
| C. | 配平后氧化剂与还原剂的化学计量数之比为4:1 | |
| D. | 标准状况下,若生成2.24LN2,则转移电子数为NA |
(1)上述实验中发生的反应有Zn+Cu2+=Zn2++Cu、Zn+2H+=Zn2++H2↑.(离子方程式)
(2)硫酸铜溶液可以加快氢气生成速率的原因是通过一系列反应构成了原电池,写出该原电池的电极反应式,负极:Zn-2e-=Zn2+;正极:2H++2e-=H2↑.
(3)要加快上述实验中气体产生的速率,还可采取的措施有BC.
A.将稀硫酸换成浓硫酸 B.适当升高温度
C.用锌粉代替锌粒 D.增加上述稀硫酸的用量
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
 ,
, ,F元素离子基态时的电子排布式1s22s22p63s23p6,E元素的原子结构示意图是
,F元素离子基态时的电子排布式1s22s22p63s23p6,E元素的原子结构示意图是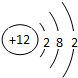 .
.