题目内容
4.实验室制取氯气除了用浓盐酸和二氧化锰反应外还可运用下列反应:KClO3+6HCl═KCl+3Cl2↑+3H2O,该反应的优点是反应产生氯气速度快、不需加热.(1)上述反应中HCl是还原剂,KClO3中的Cl元素被还原,若反应产生0.3mol氯气,则转移的电子数目为0.5NA.
(2)1943年 海维西 (1885-1966)匈牙利人,利用同位素作为化学研究中的示踪原子获诺贝尔奖.为了确定氯酸钾的还原产物,化学上常采用K37ClO3和H35Cl反应,结果表明KCl 中不含37Cl原子,试问1mol K37ClO3反应产生氯气的质量是212克.
分析 (1)由KClO3+6HCl=KCl+3Cl2↑+3H2O反应可知,KClO3中Cl元素的化合价由+5价降低为0,HCl中Cl元素的化合价由-1价升高为0,以此来解答;
(2)根据方程式计算,产物中3个Cl2中含有一个37Cl和5个35Cl.
解答 解:(1)因HCl中Cl元素的化合价升高,则HCl为该反应中的还原剂,KClO3中的Cl的化合价降低被还原,该反应中生成3molCl2转移5mole-,当反应产生0.3mol氯气,则转移的电子数目为0.5NA,
故答案为:HCl;KClO3中的Cl;0.5NA;
(2)由K37ClO3+6H35Cl=K35Cl+3Cl2↑+3H2O反应可知,1molK37ClO3反应产生3mol氯气,其中含有1mol37Cl35Cl和2mol35Cl2,其质量是212g;
故答案为:212.
点评 本题考查氧化还原反应,把握反应中元素的化合价变化为解答的关键,侧重基本概念和转移电子数目的计算,题目难度不大.

练习册系列答案
相关题目
15.下列说法中,正确的是( )
| A. | 芳香烃就是指苯和苯的同系物 | |
| B. | 通常可从煤焦油中或石油的催化重整来获取芳香烃 | |
| C. | 乙苯分子中所有原子可以处于同一平面上 | |
| D. | 苯和甲苯只能发生取代反应不能发生氧化反应 |
19.aL硫酸铝溶液中,含有n molA13+,则溶液中SO42-的物质的量浓度是( )
| A. | $\frac{3n}{2a}$ mol/L | B. | $\frac{2n}{3a}$ mol/L | C. | $\frac{2n}{a}$mol/L | D. | $\frac{3n}{a}$mol/L |
9.分类是重要的化学学习方法.下列对应关系正确的是( )
| A. | 混合物--液氯、漂白粉 | B. | 碱性氧化物--Al2O3、Na2O2 | ||
| C. | 强电解质--NH4Cl、HClO | D. | 非电解质--NH3、SO2 |
16.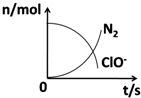 在一个氧化还原反应的体系中,共有H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
在一个氧化还原反应的体系中,共有H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
 在一个氧化还原反应的体系中,共有H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
在一个氧化还原反应的体系中,共有H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )| A. | 还原剂是含CN-的物质,氧化产物只有N2 | |
| B. | 氧化剂是ClO-,还原产物是HCO3- | |
| C. | 配平后氧化剂与还原剂的化学计量数之比为4:1 | |
| D. | 标准状况下,若生成2.24LN2,则转移电子数为NA |
 ,F元素离子基态时的电子排布式1s22s22p63s23p6,E元素的原子结构示意图是
,F元素离子基态时的电子排布式1s22s22p63s23p6,E元素的原子结构示意图是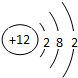 .
.