题目内容
6.体积相同的甲、乙两个容器中,分别都充有等物质的量的SO2和O2,在相同温度下发生下列反应:2SO2(g)+O2(g)?2SO3(g),并达到平衡.在这过程中甲容器压强保持不变,乙容器保持体积不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率( )| A. | 等于p% | B. | 大于p% | C. | 小于p% | D. | 无法判断 |
分析 先假定甲、乙的体积都不变,达到平衡后再保持甲的压强不变,此反应是气体体积减小的反应,因此,待等体积达平衡后,欲保持甲的压强不变,就需要缩小体积.缩小体积则甲相对于乙的压强增大,平衡正向移动.
解答 解:先假定甲、乙的体积都不变,达到平衡后再保持甲的压强不变,此反应是气体体积减小的反应,因此,待等体积达平衡后,欲保持甲的压强不变,就需要缩小体积.缩小体积时,甲相对于乙的压强增大,平衡正向移动.所以,若甲容器中SO2的转化率为P%,则乙的SO2的转化率将小于甲的,即小于P%.
故选C.
点评 这一类问题的解决方法一般如此,先设为同等条件,平衡后再改变某一条件使之符合题设条件,分析变化.这样,问题就迎刃可解了.

练习册系列答案
相关题目
17.下列有关实验的叙述中,正确的是( )
| A. | 红热的铁与水蒸气反应可生成氧化铁和氢气 | |
| B. | 将二氧化硫通入到紫色石蕊溶液中,溶液先变红后褪色 | |
| C. | 加热时,可将试管、蒸发皿、坩埚直接在酒精灯焰上加热 | |
| D. | 称量氢氧化钠固体时,应将氢氧化钠固体放在称量纸上称量 |
1.有关碱金属的叙述正确的是( )
| A. | 随核电荷数的增加,碱金属单质的熔点逐渐降低,密度逐渐增大 | |
| B. | 碱金属单质的金属性很强,均易与氯气、氧气、氮气等发生反应 | |
| C. | 碳酸铯加热时不能分解为二氧化碳和氧化铯 | |
| D. | 无水硫酸铯的化学式为Cs2SO4,它不易溶于水 |
11.设NA代表阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1molCO2与SO3的混合气体氧原子数为2NA | |
| B. | 1mol/L KClO3溶液中含有NA个ClO3- | |
| C. | 标准状况下,11.2LCCl4所含的分子数为0.5NA | |
| D. | 25℃,1.01×105Pa,88gCO2中所含原子数为6NA |
15.下列说法中,正确的是( )
| A. | 芳香烃就是指苯和苯的同系物 | |
| B. | 通常可从煤焦油中或石油的催化重整来获取芳香烃 | |
| C. | 乙苯分子中所有原子可以处于同一平面上 | |
| D. | 苯和甲苯只能发生取代反应不能发生氧化反应 |
16.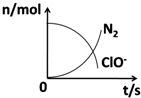 在一个氧化还原反应的体系中,共有H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
在一个氧化还原反应的体系中,共有H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
 在一个氧化还原反应的体系中,共有H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
在一个氧化还原反应的体系中,共有H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )| A. | 还原剂是含CN-的物质,氧化产物只有N2 | |
| B. | 氧化剂是ClO-,还原产物是HCO3- | |
| C. | 配平后氧化剂与还原剂的化学计量数之比为4:1 | |
| D. | 标准状况下,若生成2.24LN2,则转移电子数为NA |
 ,
,