题目内容
5.mg某双原子分子的气体在标准状况下的体积为V1L,其摩尔质量为Mg/mol,将其溶于水(该气体与水不反应)得到体积为V2L的溶液,NA表示阿伏加德罗常数的值,则下列错误的是( )| A. | 该气体分子的摩尔质量为$\frac{22.4m}{{V}_{1}}$g/mol | |
| B. | 该气体分子中含有的原子数目为$\frac{{N}_{A}{V}_{1}}{22.4}$g/mol | |
| C. | 该气体溶于水后得到溶液的物质的量浓度为$\frac{m}{M{V}_{2}}$mol/L | |
| D. | 该气体溶于水后得到溶液的物质的量浓度$\frac{{V}_{1}}{22.4{V}_{2}}$mol/L |
分析 A.根据体积计算物质的量,结合质量计算摩尔质量;
B.根据体积计算物质的量,可计算该气体分子中含有的原子数目;
C、根据n=$\frac{m}{M}$计算物质的量,已知溶液体积,根据c=$\frac{n}{V}$计算浓度;
D.根据体积计算物质的量,已知溶液体积,根据c=$\frac{n}{V}$计算浓度.
解答 解:A.n=$\frac{{V}_{1}}{22.4}$mol,M=$\frac{mg}{\frac{{V}_{1}}{22.4}mol}$=$\frac{22.4m}{{V}_{1}}$g/mol,故A正确;
B.n=$\frac{{V}_{1}}{22.4}$mol,因为双原子分子,则气体分子中含有的原子数目为$\frac{{N}_{A}{V}_{1}}{11.2}$,故B错误;
C.n=$\frac{m}{M}$,则气体溶于水后得到溶液的物质的量浓度为$\frac{m}{M{V}_{2}}$mol/L,故C正确;
D.n=$\frac{{V}_{1}}{22.4}$mol,气体溶于水后得到溶液的物质的量浓度$\frac{{V}_{1}}{22.4{V}_{2}}$mol/L故D正确.
故选B.
点评 本题考查物质的量的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握物质的构成以及相关计算公式的运用,难度不大.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
相关题目
15.下列说法中,正确的是( )
| A. | 芳香烃就是指苯和苯的同系物 | |
| B. | 通常可从煤焦油中或石油的催化重整来获取芳香烃 | |
| C. | 乙苯分子中所有原子可以处于同一平面上 | |
| D. | 苯和甲苯只能发生取代反应不能发生氧化反应 |
16.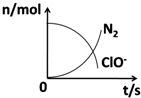 在一个氧化还原反应的体系中,共有H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
在一个氧化还原反应的体系中,共有H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
 在一个氧化还原反应的体系中,共有H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )
在一个氧化还原反应的体系中,共有H2O、ClO-、CN-、HCO3-、N2、Cl-六种物质.在反应过程中测得ClO-和N2的物质的量随时间变化的曲线如图所示.下列有关判断中正确的是( )| A. | 还原剂是含CN-的物质,氧化产物只有N2 | |
| B. | 氧化剂是ClO-,还原产物是HCO3- | |
| C. | 配平后氧化剂与还原剂的化学计量数之比为4:1 | |
| D. | 标准状况下,若生成2.24LN2,则转移电子数为NA |
13.相等物质的量的H2O和H2O2相比较,下列有关叙述中正确的是( )
①它们所含的分子数目之比为1:1 ②它们所含的原子总数目之比为3:4 ③它们所含的O原子数目之比为1:2 ④它们所含的H原子数目之比为1:1 ⑤它们所含的质子数目之比为5:9.
①它们所含的分子数目之比为1:1 ②它们所含的原子总数目之比为3:4 ③它们所含的O原子数目之比为1:2 ④它们所含的H原子数目之比为1:1 ⑤它们所含的质子数目之比为5:9.
| A. | ①②③ | B. | ③④⑤ | C. | ①②④ | D. | ①②③④⑤ |
20.下列表述不正确的是( )
| A. | 人造刚玉熔点很高,可用作高级耐火材料,主要成分是Al2O3 | |
| B. | 硅是制造太阳能电池的常用材料 | |
| C. | 四氧化三铁俗称铁红,可用于作油漆、红色涂料 | |
| D. | 分散系中分散质粒子的直径:Fe(OH)3 悬浊液>Fe(OH)3 胶体>FeCl3 溶液 |
10.锌与稀硝酸反应生成Zn(NO3)2、NH4NO3和水.当生成1mol Zn(NO3)2时,消耗的硝酸的物质的量为( )
| A. | 2mol | B. | 1mol | C. | 2.25 mol | D. | 2.5 mol |
17.某同学在用稀硫酸与锌制取氢气的实验中,发现加入少量硫酸铜溶液可加快氢气的生成速率.请回答下列问题:
(1)上述实验中发生的反应有Zn+Cu2+=Zn2++Cu、Zn+2H+=Zn2++H2↑.(离子方程式)
(2)硫酸铜溶液可以加快氢气生成速率的原因是通过一系列反应构成了原电池,写出该原电池的电极反应式,负极:Zn-2e-=Zn2+;正极:2H++2e-=H2↑.
(3)要加快上述实验中气体产生的速率,还可采取的措施有BC.
A.将稀硫酸换成浓硫酸 B.适当升高温度
C.用锌粉代替锌粒 D.增加上述稀硫酸的用量
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
①请完成此实验设计,其中:V1=30,V6=10,V9=17.5;
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
(1)上述实验中发生的反应有Zn+Cu2+=Zn2++Cu、Zn+2H+=Zn2++H2↑.(离子方程式)
(2)硫酸铜溶液可以加快氢气生成速率的原因是通过一系列反应构成了原电池,写出该原电池的电极反应式,负极:Zn-2e-=Zn2+;正极:2H++2e-=H2↑.
(3)要加快上述实验中气体产生的速率,还可采取的措施有BC.
A.将稀硫酸换成浓硫酸 B.适当升高温度
C.用锌粉代替锌粒 D.增加上述稀硫酸的用量
(4)为了进一步研究硫酸铜的量对氢气生成速率的影响,该同学设计了如下一系列实验.将表中所给的混合溶液分别加入到6个盛有过量Zn粒的反应瓶中,收集产生的气体,记录获得相同体积的气体所需时间.
| 实验 混合溶液 | A | B | C | D | E | F |
| 4mol•L-1 H2SO4/mL | 30 | V1 | V2 | V3 | V4 | V5 |
| 饱和CuSO4溶液/mL | 0 | 0.5 | 2.5 | 5 | V6 | 20 |
| H2O/mL | V7 | V8 | V9 | V10 | 10 | 0 |
②该同学最后得出的结论为:当加入少量CuSO4溶液时,生成氢气的速率会大大提高.但当加入的CuSO4溶液超过一定量时,生成氢气的速率反而会下降.请分析氢气生成速率下降的主要原因当加入一定量的硫酸铜后,生成的单质铜会沉积在锌的表面,降低了锌与溶液的接触面积.
15.下列实验操作不需要用玻璃棒的是( )
| A. | 过滤 | B. | 溶解 | C. | 蒸发 | D. | 分液 |