题目内容
13.25℃时,H2SO3?HSO${\;}_{3}^{-}$+H+的电离平衡常数Kh=1×10-2,下列说法不正确的是( )| A. | 该温度下NaHSO3 的水解平衡常数Kh=1×10-2 | |
| B. | 若向NaHSO3 溶液中加入少量的I2,则溶液中$\frac{c{(H}_{2}{SO}_{3})}{c(HS{O}_{3}^{-})}$ 将减小 | |
| C. | 略微升高温度 Ka(H2SO3)和 Kh(NaHSO3)均增大 | |
| D. | NaHSO3溶液中:c(H+)<c(S${O}_{3}^{2-}$)+c(HSO${\;}_{3}^{-}$)+c(OH-) |
分析 A、NaHSO3 的水解平衡为HSO3-+H2O?H2SO3+OH-,平衡常数为Kb=$\frac{[{H}_{2}S{O}_{3}]•[O{H}^{-}]}{[HS{{O}_{3}}^{-}]}$,电离平衡常数Kh=$\frac{[HS{{O}_{3}}^{-}]•[{H}^{+}]}{[{H}_{2}S{O}_{3}]}$,所以NaHSO3 的水解平衡常数Kb=$\frac{{K}_{W}}{电离平衡常数}$;
B、Kb=$\frac{[{H}_{2}S{O}_{3}]•{K}_{W}}{[HS{{O}_{3}}^{-}]•[{H}^{+}]}$,当加入少量I2时,碘把弱酸(亚硫酸)氧化成强酸(硫酸、氢碘酸),溶液酸性增强,[H+]增大,但是温度不变,KW、Kb不变,则$\frac{c{(H}_{2}{SO}_{3})}{c(HS{O}_{3}^{-})}$ 将增大;
C、电离和水解都是吸热的;
D、NaHSO3溶液中,存在电荷守恒,为c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),由物料守恒可知,c(HSO3-)+c(SO32-)+c(H2SO3)=c(Na+),据此分析.
解答 解:A、NaHSO3 的水解平衡为HSO3-+H2O?H2SO3+OH-,平衡常数为Kb=$\frac{[{H}_{2}S{O}_{3}]•[O{H}^{-}]}{[HS{{O}_{3}}^{-}]}$,电离平衡常数Kh=$\frac{[HS{{O}_{3}}^{-}]•[{H}^{+}]}{[{H}_{2}S{O}_{3}]}$,所以NaHSO3 的水解平衡常数Kb=$\frac{{K}_{W}}{电离平衡常数}$=$\frac{1{0}^{-14}}{1{0}^{-2}}$=10-12,故A错误;
B、Kb=$\frac{[{H}_{2}S{O}_{3}]•{K}_{W}}{[HS{{O}_{3}}^{-}]•[{H}^{+}]}$,当加入少量I2时,碘把弱酸(亚硫酸)氧化成强酸(硫酸、氢碘酸),溶液酸性增强,[H+]增大,但是温度不变,KW、Kb不变,则$\frac{c{(H}_{2}{SO}_{3})}{c(HS{O}_{3}^{-})}$ 将增大,故B错误;
C、电离和水解都是吸热的,所以略微升高温度 Ka(H2SO3)和 Kh(NaHSO3)均增大,故C正确;
D、NaHSO3溶液中,存在电荷守恒,为①c(Na+)+c(H+)=c(HSO3-)+2c(SO32-)+c(OH-),由物料守恒可知,②c(HSO3-)+c(SO32-)+c(H2SO3)=c(Na+),
①-②得:c(H+)+c(H2SO3)=c(SO32-)+c(OH-),所以c(H+)<c(SO32-)+c(HSO3-)+c(OH-),故D正确;
故选AB.
点评 本题考查了弱电解质的电离平衡常数和水解平衡常数的计算、平衡移动、离子浓度大小比较,题目难度中等.

 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案| A. | Na+→Na | B. | Cl→Cl- | C. | H+Cl→HCl | D. | H2→H+H |
| A. | 氯气通入等物质的量溴化亚铁溶液中:2Cl2+2Fe2++2 Br-=4 Cl-+2Fe3++Br2 | |
| B. | 向苯酚溶液中滴加Na2CO3溶液: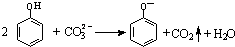 | |
| C. | 足量的CO2通入饱和碳酸钠溶液中:CO2+CO32-+H2O=2HCO3- | |
| D. | 氨水吸收过量的SO2:SO2+2NH3•H2O=SO32-+2NH4++H2O |
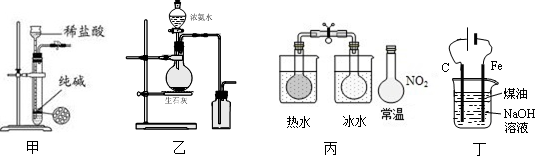
| A. | 用图甲所示装置控制制取少量纯净的CO2气体 | |
| B. | 用图乙所示装置制取并收集氨气 | |
| C. | 用图丙所示装置可以说明反应2NO2(g)?N2O4(g)是放热反应 | |
| D. | 用图丁所示装置可制备Fe(OH)2并能较长时间观察其颜色 |
| A. | 32 | B. | 67 | C. | 99 | D. | 166 |
| A. | 可用新制备的Cu(OH)2悬浊液将乙醇、乙酸、葡萄糖、蔗糖几种溶液区别开 | |
| B. | 乙烯与HCl、乙烷与Cl2这两组反应均可得到CH3CH2Cl,但二者反应类型不同 | |
| C. | 分子中有三个甲基且分子式C6H14的烃最多有三种 | |
| D. | 苯能发生加成反应、取代反应但不能发生氧化反应 |
 CO2
CO2

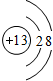 Cl
Cl .
.
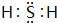 .
.
 .
.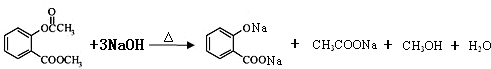 .
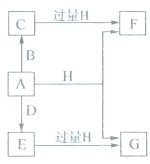
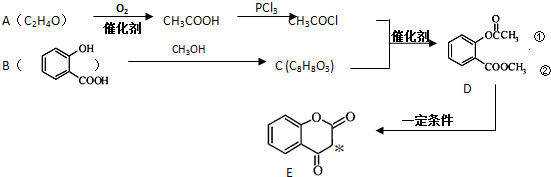
.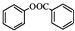 ),根据题目信息设计合成线路,请写出最后一步反应的化学方程式:
),根据题目信息设计合成线路,请写出最后一步反应的化学方程式: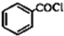 +
+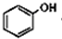 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$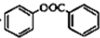 +HCl.
+HCl.