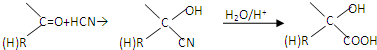
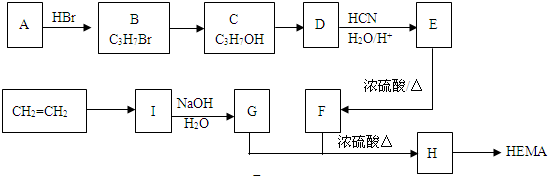
题目内容
13.下列变化过程吸收能量的是( )| A. | Na+→Na | B. | Cl→Cl- | C. | H+Cl→HCl | D. | H2→H+H |
分析 A.得到电子能量升高;
B.得到电子能量升高;
C.原子形成化学键放出能量;
D.断裂化学键吸收能量.
解答 解:A.Na+→Na得到电子能量升高,故A错误;
B.Cl→Cl-得到电子能量升高,故B错误;
C.H+Cl→HCl是一种形成化学键的过程,过程中放热,原子形成化学键放出能量,故C错误;
D.H2→H+H是断裂化学键的过程,断裂化学键吸收能量,故D正确.
故选D.
点评 本题考查了化学反应的本质,注意化学键断裂吸热,化学键形成放热,得到电子能量升高,题目较简单.

练习册系列答案
相关题目
4.关于化学键的下列叙述中,正确的是( )
| A. | 离子化合物一定含共价键 | B. | 共价化合物可能含离子键 | ||
| C. | 离子化合物中只含离子键 | D. | 共价化合物中肯定不含离子键 |
1.下列物质中含有共价键的离子化合物是( )
| A. | NaNO3 | B. | MgCl2 | C. | SiO2 | D. | C2H4 |
8.下列反应的有机产物中只有一种的是( )
| A. | CH3CH═CH2与HCl加成 | B. | CH3CH2CH2Cl在碱性溶液中水解 | ||
| C. | CH3CH2OH与浓H2SO4混合加热 | D. | CH3CHBrCH2CH3与NaOH醇溶液共热 |
18.在稀硫酸中加入铜粉,铜粉不溶,再加入下列物质①FeCl3,②Fe2O3,③Cu(NO3)2,④KNO3,
铜粉溶解的是( )
铜粉溶解的是( )
| A. | 只有①或② | B. | 只有②或④ | C. | 只有①或②或③ | D. | 上述物质均可 |
5.下列化学用语正确的是( )
| A. | 氯化氢的电子式: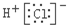 | B. | N2的结构式:N≡N | ||
| C. | 硫离子结构示意图: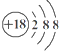 | D. | 四氯化碳的电子式: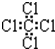 |
13.25℃时,H2SO3?HSO${\;}_{3}^{-}$+H+的电离平衡常数Kh=1×10-2,下列说法不正确的是( )
| A. | 该温度下NaHSO3 的水解平衡常数Kh=1×10-2 | |
| B. | 若向NaHSO3 溶液中加入少量的I2,则溶液中$\frac{c{(H}_{2}{SO}_{3})}{c(HS{O}_{3}^{-})}$ 将减小 | |
| C. | 略微升高温度 Ka(H2SO3)和 Kh(NaHSO3)均增大 | |
| D. | NaHSO3溶液中:c(H+)<c(S${O}_{3}^{2-}$)+c(HSO${\;}_{3}^{-}$)+c(OH-) |