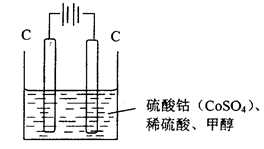
题目内容
(1)已知:P4(白磷,s)+5O2(g)=P4O10(s) ΔH=-2983.2kJ/mol
P(红磷,s)+5/4O2(g)=1/4 P4O10(s) ΔH=-738.5kJ/mol
则白磷转化为红磷的热化学方程式为 ;由此说明红磷的稳定性比白磷 。
(2)明矾[KAl(SO4)2·12H2O]水溶液呈 (填“酸”、“碱”或“中”)性;明矾还能净水,用离子方程式解释其原因为 。
(3)电解池的能量转化形式为 ,原电池反应 (填“一定”或“不一定”)自发。
(4)pH=3的盐酸和pH=3的醋酸溶液各稀释至其体积的100倍,稀释后盐酸的pH (填“大于”、“小于”或“等于”)醋酸的pH;常温时pH=x的盐酸和pH=y的NaOH溶液以1︰10的体积比混合,反应后溶液恰好呈中性,则x、y满足的关系是 。
P(红磷,s)+5/4O2(g)=1/4 P4O10(s) ΔH=-738.5kJ/mol
则白磷转化为红磷的热化学方程式为 ;由此说明红磷的稳定性比白磷 。
(2)明矾[KAl(SO4)2·12H2O]水溶液呈 (填“酸”、“碱”或“中”)性;明矾还能净水,用离子方程式解释其原因为 。
(3)电解池的能量转化形式为 ,原电池反应 (填“一定”或“不一定”)自发。
(4)pH=3的盐酸和pH=3的醋酸溶液各稀释至其体积的100倍,稀释后盐酸的pH (填“大于”、“小于”或“等于”)醋酸的pH;常温时pH=x的盐酸和pH=y的NaOH溶液以1︰10的体积比混合,反应后溶液恰好呈中性,则x、y满足的关系是 。
(1)P4(白磷,s)=4P(红磷,s) △H=-29.2kJ/mol 高(或“好”、“强”等)
(2)酸 Al3++3H2O
 Al(OH)3(胶体)+3H+
Al(OH)3(胶体)+3H+(3)电能转化为化学能 一定
(4)大于 x+y=13
试题分析:(1)反应①-②×4得出P4(白磷,s)=4P(红磷,s) △H=-29.2kJ/mol,反应放热红磷更稳定;(2)明矾中铝离子水解呈酸性;(4)稀释时醋酸能电离出氢离子,所以稀释后盐酸的pH大于醋酸;根据条件列等式为10-x×1=10-(14-y)×10 x+y=13

练习册系列答案
 应用题天天练四川大学出版社系列答案
应用题天天练四川大学出版社系列答案
相关题目
 H3O++S2-
H3O++S2- 2NH3(g) △H<0,其他条件不变时升高温度,反应速率V(H2)增大,氢气的平衡转化率变小
2NH3(g) △H<0,其他条件不变时升高温度,反应速率V(H2)增大,氢气的平衡转化率变小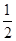 O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1
O2(g)=CO2(g) ΔH=-283.0 kJ·mol-1 ,其它条件不变时加入催化剂,反应速率v(SO2)和SO2转化率均增大
,其它条件不变时加入催化剂,反应速率v(SO2)和SO2转化率均增大 CO2(g)+H2(g),得到如下两组数据:
CO2(g)+H2(g),得到如下两组数据: