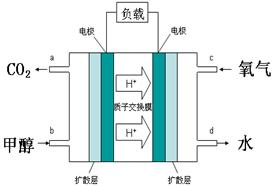
题目内容
下列叙述中正确的是
| A.电解法精炼铜时,以粗铜作阴极,纯铜作阳极 |
| B.向沸水中滴加FeCl3饱和溶液制备Fe(OH)3胶体 |
| C.常温下,将pH =10的氨水稀释,溶液中所有离子浓度都减小 |
| D.反应NH3(g)+HCl(g)=NH4Cl(s)在室温下可自发进行,则该反应的△H<0 |
BD
试题分析:A、电解法精炼铜时,以粗铜作阳极失电子,纯铜作阴极,在阴极表面Cu2+得到电子生成Cu,错误;B、制备Fe(OH)3胶体是利用了Fe3+的水解,方程式为Fe3++3H2O
 Fe(OH)3+3H+,升温促进水解,正确;C、氨水稀释时,c(OH)减小,由于Kw= c(OH)·c(H+),所以c(H+)逐渐增大,错误;D、本反应的△S<0,室温下可自发进行,必须满足△H<0,正确。
Fe(OH)3+3H+,升温促进水解,正确;C、氨水稀释时,c(OH)减小,由于Kw= c(OH)·c(H+),所以c(H+)逐渐增大,错误;D、本反应的△S<0,室温下可自发进行,必须满足△H<0,正确。
练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
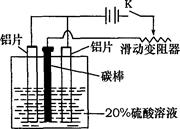
 2CO2+N2△H<0,则该反应一定能自发进行
2CO2+N2△H<0,则该反应一定能自发进行 2NH3(g),其他条件不变时充入N2,正逆反应速率均增大
2NH3(g),其他条件不变时充入N2,正逆反应速率均增大 H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深,符合勒夏特列原理解释。
H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深,符合勒夏特列原理解释。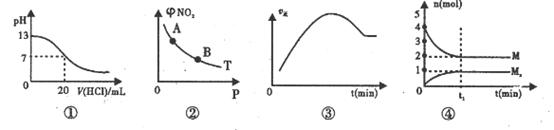
 N2O4(g)达到平衡时NO2的体积分数
N2O4(g)达到平衡时NO2的体积分数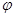 (NO2)随压强P的变化如图②所示,则A点的颜色深,B点的颜色浅
(NO2)随压强P的变化如图②所示,则A点的颜色深,B点的颜色浅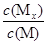 将增大
将增大 CH3OH(g) ⊿H
CH3OH(g) ⊿H