题目内容
下列有关说法正确的是
| A.BaSO3(s)+4C(s)=BaS(s)+4CO(g)室温下不能自发进行,说明该反应的△H>0 |
| B.纯铁和生铁在酸雨中均发生电化学腐蚀 |
C. ,其它条件不变时加入催化剂,反应速率v(SO2)和SO2转化率均增大 ,其它条件不变时加入催化剂,反应速率v(SO2)和SO2转化率均增大 |
| D.0.1mol·L-1Na2CO3溶液在35℃时碱性比25℃强,说明盐类水解反应是放热反应 |
A
试题分析:A、反应能否自发进行的判据有两个,该反应的△S>0,所以只有△H>0反应才不能自发进行,正确;B、纯铁不能形成原电池,不能发生电化学腐蚀,错误;C、催化剂只能改变反应速率,但不能改变反应的转化率,错误;D、该事实说明盐类水解反应是吸热反应,错误。

练习册系列答案
相关题目
 ,
,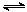 2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大
2SO3(g),压缩气体体积使压强增大(其他条件不变),则SO2的转化率增大,平衡常数K也增大 的值不变
的值不变 H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深,符合勒夏特列原理解释。
H2(g)+I2(g)平衡体系,增大平衡体系的压强可使颜色变深,符合勒夏特列原理解释。
 CO(g)+H2(g),则可用来判断该反应达到平衡状态的标志有 。(填字母)
CO(g)+H2(g),则可用来判断该反应达到平衡状态的标志有 。(填字母) HCOOCH3(g) △H=-29.1 kJ·mol-1
HCOOCH3(g) △H=-29.1 kJ·mol-1
 CO2(g) + H2(g)△H1=" +" 41.2kJ/mol
CO2(g) + H2(g)△H1=" +" 41.2kJ/mol