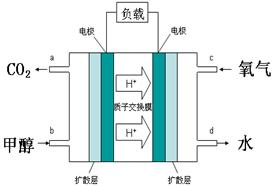
题目内容
归纳法是髙中化学学习常用的方法之一,某化学研究性学习小组在学习了《化学反应原理》后作出了如下的归纳总结:(均在常温下)
①pH=1的强酸溶液,加水稀释后,溶液中离子浓度都降低。
②pH=2的盐酸和pH=l的盐酸,c(H+)之比为2 :1
③pH相等的三种溶液:a.CH3COONa b.NaHCO3 c.NaOH,其溶质物质的量浓度由小到大顺序为:c、b、a
④反应2A(s)+B (g)="2C" (g)+D (g)不能自发进行,则该反应△H一定大于0
⑤已知醋酸电离平衡常数为Ka,醋酸根水解常数为Kb,水的离子积为Kw,则三者关系为:Ka·Kb=Kw
⑥反应A(g)="2" B (g) △H,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ.mol-1,则△H=(Ea-Eb)kJ·mol-1
上述归纳正确的是
①pH=1的强酸溶液,加水稀释后,溶液中离子浓度都降低。
②pH=2的盐酸和pH=l的盐酸,c(H+)之比为2 :1
③pH相等的三种溶液:a.CH3COONa b.NaHCO3 c.NaOH,其溶质物质的量浓度由小到大顺序为:c、b、a
④反应2A(s)+B (g)="2C" (g)+D (g)不能自发进行,则该反应△H一定大于0
⑤已知醋酸电离平衡常数为Ka,醋酸根水解常数为Kb,水的离子积为Kw,则三者关系为:Ka·Kb=Kw
⑥反应A(g)="2" B (g) △H,若正反应的活化能为Ea kJ·mol-1,逆反应的活化能为Eb kJ.mol-1,则△H=(Ea-Eb)kJ·mol-1
上述归纳正确的是
| A.全部 | B.③④⑤⑥ | C.②④⑤⑥ | D.①②④⑤ |
B
试题分析:加水稀释后,酸中的c(H+)减小,但溶液中的c(OH-)增大,①错;pH=2的酸c(H+)=10-2mol·L-1,pH=1的酸c(H+)=10-1mol·L-1,c(H+)之比为1:10,②错;CH3COONa、NaHCO3溶液水解后显碱性,但HCO3-的水解程度大于CH3COO-,因此pH相等时NaHCO3溶液浓度小,NaOH是强碱,相同pH时浓度最小,③正确;该反应是熵增的反应,不能自发进行则△H一定大于0,④正确;醋酸的电离平衡常数
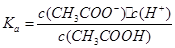 ,醋酸跟的水解常数
,醋酸跟的水解常数 ,则Ka·Kb= c(H+)·c(OH-)=Kw,⑤正确;正反应的活化能为反应物断裂化学键吸收的能量,逆反应的活化能为生成物形成化学键释放的能量,故反应热正反应活化能减去逆反应活化能,⑥正确。
,则Ka·Kb= c(H+)·c(OH-)=Kw,⑤正确;正反应的活化能为反应物断裂化学键吸收的能量,逆反应的活化能为生成物形成化学键释放的能量,故反应热正反应活化能减去逆反应活化能,⑥正确。
练习册系列答案
相关题目
 2CO2+N2△H<0,则该反应一定能自发进行
2CO2+N2△H<0,则该反应一定能自发进行 2NH3(g),其他条件不变时充入N2,正逆反应速率均增大
2NH3(g),其他条件不变时充入N2,正逆反应速率均增大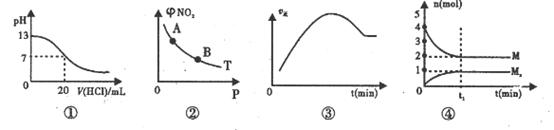
 N2O4(g)达到平衡时NO2的体积分数
N2O4(g)达到平衡时NO2的体积分数 (NO2)随压强P的变化如图②所示,则A点的颜色深,B点的颜色浅
(NO2)随压强P的变化如图②所示,则A点的颜色深,B点的颜色浅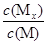 将增大
将增大 2C(g)达平衡后,恒温,增压,平衡正向移动,平衡常数K值增大
2C(g)达平衡后,恒温,增压,平衡正向移动,平衡常数K值增大
 CH3OH(g) ⊿H
CH3OH(g) ⊿H