题目内容
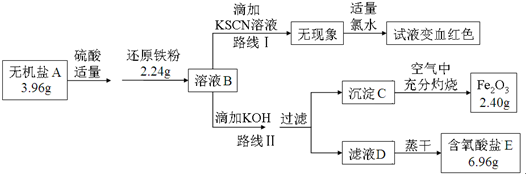
8.中学化学中很多“规律”都有其适用范围,下列根据有关“规律”推出的结论正确的是( )| 选项 | 规律 | 结论 |
| A | 非金属性越强,其气态氢化物越稳定 | 稳定性:NH3>PH3 |
| B | 反应物浓度越大,反应速率越快 | 常温下,相同的铁片中分别加入足量的浓、稀硝酸,浓硝酸中铁片先溶解完 |
| C | 结构和组成相似的物质,沸点随相对分子质量增大而升高 | HF沸点低于HCl |
| D | 浓硫酸不能干燥具有还原性的气体 | 浓硫酸不可以干燥SO2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.依据元素非金属性强弱判断依据解答;
B.铁遇到浓硝酸在常温下发生钝化;
C.氟化氢分子间存在氢键;
D.浓硫酸具有强氧化性,但不能氧化二氧化硫.
解答 解:A.非金属性越强,其气态氢化物越稳定,氮元素非金属性强于磷,所以稳定性:NH3>PH3,故A正确;
B.铁遇到浓硝酸在常温下发生钝化,形成致密氧化膜,阻止反应进行,所以常温下,相同的铁片中分别加入足量的浓、稀硝酸,稀硝酸中铁片先溶解完,故B错误;
C.氟化氢分子之间存在氢键,使物质的熔沸点升高,所以HF沸点高于HCl,故C错误;
D.浓硫酸具有强氧化性,二氧化硫具有还原性,但不能氧化二氧化硫,所以能干燥二氧化硫,故D错误;
故选:A.
点评 本题考查了元素非金属性强弱的判断依据、氢键对物质沸点的影响、浓硝酸、浓硫酸的性质,注意铁与浓硝酸在常温下发生钝化,题目难度不大.

练习册系列答案
 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案
相关题目
18.O3也是一种很好的消毒剂,具有高效、洁净、方便、经济等优点.O3可溶于水,在水中易分解,产生的[O]为游离氧原子,有很强的杀菌消毒能力.常温常压下发生反应如下:
反应①O3?O2+[O]△H>0 平衡常数为K1;
反应②[O]+O3?2O2△H<0 平衡常数为K2;
总反应:2O3?3O2△H<0 平衡常数为K
下列叙述正确的是( )
反应①O3?O2+[O]△H>0 平衡常数为K1;
反应②[O]+O3?2O2△H<0 平衡常数为K2;
总反应:2O3?3O2△H<0 平衡常数为K
下列叙述正确的是( )
| A. | 升高温度,K增大 | B. | K=K1+K2 | ||
| C. | 适当升温,可提高消毒效率 | D. | 压强增大,K2减小 |
16.硅是重要的半导体材料,构成了现代电子工业的基础.回答下列问题:
(1)基态Si原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9、电子数为4.
(2)硅主要以硅酸盐、二氧化硅等化合物的形式存在于地壳中.
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以共价键相结合,其晶胞中共有8个原子,其中在面心位置贡献3个原子.
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2.
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
①硅与碳同族,也有系列氢化物,但硅烷在种类和数量上都远不如烷烃多,原因是C-C键和C-H键较强,所形成的烷烃稳定.而硅烷中Si-Si键和Si-H键的键能较低,易断裂,导致长链硅烷难以生成.
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
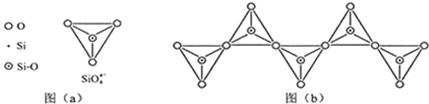
(6)在硅酸盐中,SiO44-四面体(如图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为sp3.Si与O的原子数之比为1:3.
(1)基态Si原子中,电子占据的最高能层符号为M,该能层具有的原子轨道数为9、电子数为4.
(2)硅主要以硅酸盐、二氧化硅等化合物的形式存在于地壳中.
(3)单质硅存在与金刚石结构类似的晶体,其中原子与原子之间以共价键相结合,其晶胞中共有8个原子,其中在面心位置贡献3个原子.
(4)单质硅可通过甲硅烷(SiH4)分解反应来制备.工业上采用Mg2Si和NH4Cl在液氨介质中反应制得SiH4,该反应的化学方程式为Mg2Si+4NH4Cl=SiH4+4NH3+2MgCl2.
(5)碳和硅的有关化学键键能如下所示,简要分析和解释下列有关事实:
| 化学键 | C-C | C-H | C一O | Si-Si | Si-H | Si一O |
| 键能/(kJ•mol-1) | 356 | 413 | 336 | 226 | 318 | 452 |
②SiH4的稳定性小于CH4,更易生成氧化物,原因是C-H键的键能大于C-O键,C-H键比C-O键稳定.而Si-H键的键能却远小于Si-O键,所以Si-H键不稳定而倾向于形成稳定性更强的Si-O键.
(6)在硅酸盐中,SiO44-四面体(如图(a))通过共用顶角氧离子可形成岛状、链状、层状、骨架网状四大类结构型式.图(b)为一种无限长单链结构的多硅酸根,其中Si原子的杂化形式为sp3.Si与O的原子数之比为1:3.

13.设NA表示阿伏加德罗常数的值,下列叙述中正确的是( )
| A. | pH=2的盐酸溶液中含有的阳离子数为0.02NA | |
| B. | 1mol Fe2+与足量的H2O2溶液反应,转移2NA个电子 | |
| C. | 标准状况下,22.4L CHCl3所含有的分子数目为NA | |
| D. | 27g铝与足量的盐酸或NaOH溶液反应转移的电子数目均为3NA |
20.下列有关电解质溶液中粒子浓度关系正确的是( )
| A. | 含有AgCl和AgI固体的悬浊液:c(Ag+)>c(C1-)=c(I-) | |
| B. | pH=1的NaHSO4溶液:c(H+)═c(SO42-)+c(OH-) | |
| C. | 常温下,0.1mol•L-1的①NH4Cl ②CH3COONH4 ③NH4HSO4溶液中:c(NH4+)大小顺序:①>②>③ | |
| D. | 物质的量浓度之比为1:2的NaClO、NaHCO3混合溶液中:c(HClO)+c(ClO-)═2c(HCO${\;}_{3}^{-}$)+2c(H2CO3)+2c(CO${\;}_{3}^{2-}$) |
17.下列有关(NH4)2Fe(SO4)2溶液的叙述正确的是( )
| A. | 该溶液中,K+、Mg2+、NH3•H2O、Cl-可以大量共存 | |
| B. | 与足量Ba(OH)2溶液反应的离子方裎式:Fe2++SO42-+Ba2++2OH-=Fe(OH)2↓+BaSO4↓ | |
| C. | (NH4)2Fe(SO4)2溶液久置空气中变质的离子方程式:12Fe2++3O2+6H2O=4Fe(OH)3↓+8Fe3+ | |
| D. | 向该溶液中滴加适量的酸性KMnO4溶液使其恰好反应溶液褪为无色 |
 ;六元环状化合物I
;六元环状化合物I .
.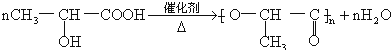 .
.