题目内容
【题目】铁及其化合物在生产和生活中有广泛的应用。
Ⅰ、高铁酸钠(Na2FeO4)是一种新型净水剂,工业上制备高铁酸钠的反应原理为:
Fe(OH)3 + NaClO + NaOH →Na2FeO4 + X + H2O(未配平), 则X的电子式为_______ ,反应中被氧化的物质是_________(写化学式)。
Ⅱ、铁红颜料跟某些油料混合,可以制成防锈油漆。工业制硫酸产生的硫酸渣中主要含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:
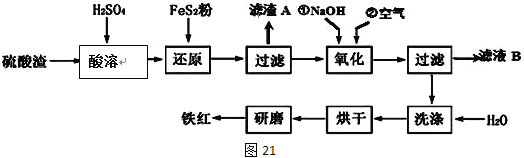
已知:
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
已知FeS2是一种黄色难溶于水的固体。
(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为______________________;
“滤渣A”主要成份的化学式为__________________。
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,写出该反应的离子方程式_________________。
(3)为确保铁红的质量和纯度,氧化过程中加NaOH调节溶液pH的范围是____;如果加NaOH调节溶液pH=a,则滤液B中c(Fe3+)=____mol/L(25℃时,Ksp[Fe(OH)3]=4×10﹣38)
(4)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可以构成燃料电池。该电池负极的电极反应式为________________ 。
【答案】 ![]() Fe(OH)3 Fe2O3 + 3H2SO4 == Fe2(SO4) 3 + 3H2O SiO2 FeS2 +14 Fe3 + + 8 H2O =15Fe2 + + 2 SO42- + 16 H+ 。 3.2≤PH<3.8 4×10(4-3a) CH3OCH3+16OH--12e-=2CO32-+11H2O
Fe(OH)3 Fe2O3 + 3H2SO4 == Fe2(SO4) 3 + 3H2O SiO2 FeS2 +14 Fe3 + + 8 H2O =15Fe2 + + 2 SO42- + 16 H+ 。 3.2≤PH<3.8 4×10(4-3a) CH3OCH3+16OH--12e-=2CO32-+11H2O
【解析】Ⅰ、根据元素化合价变化配平书写化学方程式,铁元素化合价+3价变化为+6价,氯元素化合价+1价应变化为-1价,2Fe(OH)3+3NaClO+4NaOH=2Na2FeO4+3X+5H2O可知,反应前铁、氧、氢、钠、氯的原子个数分别是:2、13、10、7、3,反应后铁、氧、氢、钠、氯的原子个数分别是:2、13、10、4、0,所以每个X中含有1个钠离子和1个氯离子,X是氯化钠,其电子式为![]() ,反应中被氧化的物质是Fe(OH)3;
,反应中被氧化的物质是Fe(OH)3;
Ⅱ、硫酸渣中含Fe2O3、SiO2、Al2O3、MgO等,稀硫酸溶解主要除去不与酸反应的SiO2,加入FeS2将溶液中的Fe3+还原为Fe2+,再加氢氧化钠和空气,调节溶液的pH的范围是3.2~3.8主要是使三价铁沉淀,而二价镁,三价铝都不沉淀,最后洗涤、烘干、研磨使氢氧化铁分解生成氧化铁,从而得到铁红;
(1)氧化铁与硫酸反应生成硫酸铁和水,方程式为:Fe2O3+3H2SO4═Fe2(SO4) 3+3H2O;因二氧化硅不与硫酸反应,故“滤渣A”主要成份的化学式为SiO2;
(2)FeS2中S元素的化合价从-1价升高到+6价,2个S原子转移14个电子,Fe3+转移1个电子,则二者的计量数之比为1:14,根据S守恒可知SO42-前面的化学计量数为2,根据氧守恒可知H20前面化学计量数为8,根据H守恒可知H+前化学计量数为16,则反应的离子方程式为:FeS2+14Fe3++8H2O═15Fe2++2SO42-+16H+;
(3)根据几种离子沉淀的pH,使Fe3+沉淀完全的PH为3.2,其他离子开始沉淀PH为3.8,因此所选PH因介于3.2和3.8之间,如果加NaOH调节溶液的pH=a,c(OH-)=![]() ,25℃时,Ksp[Fe(OH)3]=4×10-38 ,则滤液B中的c(Fe3+)=
,25℃时,Ksp[Fe(OH)3]=4×10-38 ,则滤液B中的c(Fe3+)=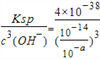 =4×10(4-3a);
=4×10(4-3a);
(4)该燃料电池中,负极上甲醚失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OCH3+16OH--12e-=2CO32-+11H2O。

【题目】用图中所示的装置进行实验,实验现象与预测不一致的是( )
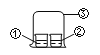
选项 | ①中的物质 | ②中的物质 | 预测现象 |
A | 浓氨水 | FeCl3溶液 | ②中有红褐色沉淀 |
B | 浓氨水 | 浓盐酸 | ③中有白烟 |
C | 浓硝酸 | 淀粉KI溶液 | ②中溶液无明显变化 |
D | 浓盐酸 | 酚酞溶液 | ②中溶液无明显变化 |
A. A B. B C. C D. D