题目内容
【题目】手持技术是基于数据采集器、传感器和多媒体计算机构成的一种新兴掌上试验系统,具有实时、定量、直观等特点,图2是利用手持技术得到的微粒的物质的量的变化图,常温下向20mL 0.2mol/L H2A溶液中滴加0.2mol/L NaOH溶液,其中Ⅰ代表H2A,Ⅱ代表HA- ,Ⅲ代表A2-,下列说法正确的是( )
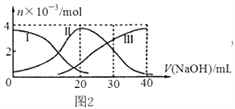
A. H2A在水中的电离方程式是:H2A═2H++A2-
B. 当V(NaOH)=40mL时,其溶液中水的电离受到抑制
C. 当V(NaOH)=20mL时,则有:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)
D. 当V(NaOH)=30mL时,则有:c(H+) +c(Na+)═ c(A2-)+ c(OH-)+ c(HA-)
【答案】C
【解析】A.0.2molL-1H2A溶液c(H+)<0.4mol/L,则H2A在溶液中部分电离,为弱酸,H2A在水中的电离方程式是:H2AH++HA-、HA-H++A2-,故A错误;B.当V(NaOH)=40mL时,恰好生成Na2A溶液,A2-的水解促进水的电离,故B错误;C.当V(NaOH)=20 mL时,发生反应为NaOH+H2A=NaHA+H2O,溶液主要为NaHA,HA-电离大于水解,溶液显酸性,则c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-),故C正确;D.当V(NaOH)=30mL时,发生反应为NaOH+H2A=NaHA+H2O,NaHA+NaOH=Na2A+H2O,溶液主要为等物质量的NaHA,Na2A的混合溶液,根据电荷守恒得:c(Na+)+c(H+)=c(HA-)+2c(A2-)+c(OH-),故D错误;故选C。

【题目】铁及其化合物在生产和生活中有广泛的应用。
Ⅰ、高铁酸钠(Na2FeO4)是一种新型净水剂,工业上制备高铁酸钠的反应原理为:
Fe(OH)3 + NaClO + NaOH →Na2FeO4 + X + H2O(未配平), 则X的电子式为_______ ,反应中被氧化的物质是_________(写化学式)。
Ⅱ、铁红颜料跟某些油料混合,可以制成防锈油漆。工业制硫酸产生的硫酸渣中主要含Fe2O3、SiO2、Al2O3、MgO等,用硫酸渣制备铁红(Fe2O3)的过程如下:
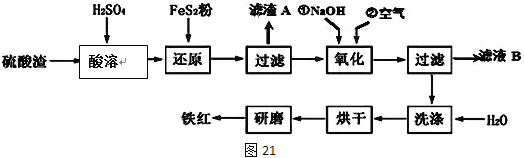
已知:
沉淀物 | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
开始沉淀pH | 2.7 | 3.8 | 7.6 | 9.4 |
完全沉淀pH | 3.2 | 5.2 | 9.7 | 12.4 |
已知FeS2是一种黄色难溶于水的固体。
(1)酸溶过程中Fe2O3与稀硫酸反应的化学方程式为______________________;
“滤渣A”主要成份的化学式为__________________。
(2)还原过程中加入FeS2的目的是将溶液中的Fe3+还原为Fe2+,而本身被氧化为H2SO4,写出该反应的离子方程式_________________。
(3)为确保铁红的质量和纯度,氧化过程中加NaOH调节溶液pH的范围是____;如果加NaOH调节溶液pH=a,则滤液B中c(Fe3+)=____mol/L(25℃时,Ksp[Fe(OH)3]=4×10﹣38)
(4)以甲醚、空气、氢氧化钾溶液为原料,石墨为电极可以构成燃料电池。该电池负极的电极反应式为________________ 。