��Ŀ����
����Ŀ���黯�أ�GaAs���������İ뵼����ϣ������������ͼ�������̫���ܵ�صIJ��ϵȡ��ش��������⣺
��1��д����̬Asԭ�ӵĺ�������Ų�ʽ________________________��
��2������Ԫ�������ɣ�ԭ�Ӱ뾶Ga_____________As����һ������Ga____________As��������ڡ���С�ڡ���
��3��AsCl3���ӵ����幹��Ϊ____________________������As���ӻ��������Ϊ_________��
��4��GaF3���۵����1000����GaCl3���۵�Ϊ77.9������ԭ����_____________________��
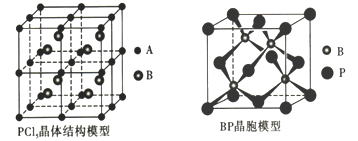
��5��GaAs���۵�Ϊ1238�����ܶ�Ϊ��g��cm-3���侧���ṹ��ͼ��ʾ���þ��������Ϊ________________,Ga��As��________�����ϡ�Ga��As��Ħ�������ֱ�ΪMGa g��mol-1��MAs g��mol-1��ԭ�Ӱ뾶�ֱ�ΪrGa pm��rAs pm������٤������ֵΪNA����GaAs������ԭ�ӵ����ռ��������İٷ���Ϊ____________________��
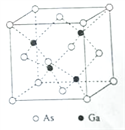
���𰸡� ![]() ���� С�� ������ sp3 GaF3�����Ӿ��壬GaCl3�Ƿ��Ӿ��壬���Ӿ���GaF3���۷е�� ԭ�Ӿ��� ���ۼ�
���� С�� ������ sp3 GaF3�����Ӿ��壬GaCl3�Ƿ��Ӿ��壬���Ӿ���GaF3���۷е�� ԭ�Ӿ��� ���ۼ� 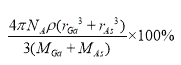
���������������: ��1��AsΪ��A��33��Ԫ�أ������Ų�ʽΪ��1s22s22p63s23p63d104s24p3��
��2��ͬһ���ڣ�ԭ������ԽС�뾶Խ��ͬ���ڵ�һ�����ܴ����ң�������
��3��AsCl3�м۲���ӶԸ���=�Ҽ�����+�µ��ӶԸ���=3+1 =4������ԭ���ӻ���ʽ��sp3��������һ�Թ¶Ե��Ӷԣ����ӿռ乹��Ϊ�����Σ�
��4��GaF3���۵����1000����GaCl3���۵�Ϊ77.9������ԭ����GaF3Ϊ���Ӿ��壬GaCl3Ϊ���Ӿ��壬���Ӿ�����۵�ߣ�
��5��GaAs���۵�Ϊ1238�����۵�ϸߣ��Թ��ۼ�����γ�����ԭ�Ӿ��壬�ܶ�Ϊ�� g![]() cm��3�����ݾ�̯�����㣬As��
cm��3�����ݾ�̯�����㣬As�� ![]() ��Ga��4��1=4��rGapm��rAspm�����侧����ԭ����ռ�����V1=
��Ga��4��1=4��rGapm��rAspm�����侧����ԭ����ռ�����V1=![]() ��10��30��1�����������V2=
��10��30��1�����������V2= ![]() ����V1��V2������� GaAs������ԭ�ӵ����ռ��������İٷ�����
����V1��V2������� GaAs������ԭ�ӵ����ռ��������İٷ�����
�������������Ϸ�������1��AsΪ��A��33��Ԫ�أ������Ų�ʽΪ��1s22s22p63s23p63d104s24p3��
��2������Ԫ�������ɣ�Ga��Asλ��ͬһ���ڣ�Gaԭ������С��As���ʰ뾶Ga����As��ͬ���ڵ�һ�����ܴ����ң������ʵ�һ������GaС��As��
��3��AsCl3�м۲���ӶԸ���=�Ҽ�����+�µ��ӶԸ���=3+1 =4������ԭ���ӻ���ʽ��sp3��������һ�Թ¶Ե��Ӷԣ����ӿռ乹��Ϊ��������
��4��GaF3���۵����1000�棬GaCl3���۵�Ϊ77.9������ԭ����GaF3Ϊ���Ӿ��壬GaCl3Ϊ���Ӿ��壬���Ӿ�����۵����
��5��GaAs���۵�Ϊ1238�棬�۵�ϸߣ��Թ��ۼ�����γ�����ԭ�Ӿ��壬�ܶ�Ϊ�� gcm��3�����ݾ�̯�����㣬As�� ![]() ��Ga��4��1=4�����侧����ԭ����ռ�����V1=
��Ga��4��1=4�����侧����ԭ����ռ�����V1=![]() ��10��30�����������V2=
��10��30�����������V2= ![]() ����GaAs������ԭ�ӵ����ռ��������İٷ���Ϊ ��V1��V2�������ðٷ���=
����GaAs������ԭ�ӵ����ռ��������İٷ���Ϊ ��V1��V2�������ðٷ���= 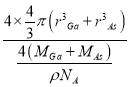 ��100%=
��100%=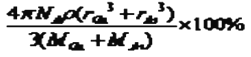 ��
��

 �������Ӧ���⼯ѵϵ�д�
�������Ӧ���⼯ѵϵ�д�����Ŀ�������仯�������������������й㷺��Ӧ�á�
�������ƣ�Na2FeO4����һ�����;�ˮ������ҵ���Ʊ��������Ƶķ�Ӧԭ��Ϊ��
Fe(OH)3 + NaClO + NaOH ��Na2FeO4 + X + H2O(δ��ƽ), ��X�ĵ���ʽΪ_______ ����Ӧ�б�������������_________��д��ѧʽ����
���������ϸ�ijЩ���ϻ�ϣ������Ƴɷ������ᡣ��ҵ���������������������Ҫ��Fe2O3��SiO2��Al2O3��MgO�ȣ����������Ʊ����죨Fe2O3���Ĺ������£�
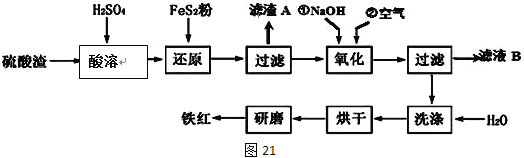
��֪��
������ | Fe(OH)3 | Al(OH)3 | Fe(OH)2 | Mg(OH)2 |
��ʼ����pH | 2.7 | 3.8 | 7.6 | 9.4 |
��ȫ����pH | 3.2 | 5.2 | 9.7 | 12.4 |
��֪FeS2��һ�ֻ�ɫ������ˮ�Ĺ��塣
��1�����ܹ�����Fe2O3��ϡ���ᷴӦ�Ļ�ѧ����ʽΪ______________________��
������A����Ҫ�ɷݵĻ�ѧʽΪ__________________��
��2����ԭ�����м���FeS2��Ŀ���ǽ���Һ�е�Fe3+��ԭΪFe2+��������������ΪH2SO4��д���÷�Ӧ�����ӷ���ʽ_________________��
��3��Ϊȷ������������ʹ��ȣ����������м�NaOH������ҺpH�ķ�Χ��____�������NaOH������ҺpH=a������ҺB��c��Fe3+��=____mol/L��25��ʱ��Ksp[Fe(OH)3]=4��10��38��
��4���Լ��ѡ�����������������ҺΪԭ�ϣ�ʯīΪ�缫���Թ���ȼ�ϵ�ء��õ�ظ����ĵ缫��ӦʽΪ________________ ��