题目内容
【题目】研究氮氧化合物的治理是环保的一项重要工作,合理应用和处理氮的化合物,在生产生活中有着重要的意义。
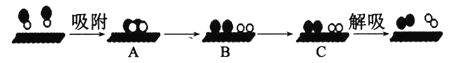
(1)已知:N2(g)+O2(g)=2NO(g) △H=+181.5 kJ·mol-1某科研小组尝试利用固体表面催化工艺进行NO的分解。若用●● 、●○ 、○○和![]() 分别表示N2 、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如下图所示。从吸附到解吸的过程中,能量状态最低的是___________(填字母序号)。
分别表示N2 、NO、O2和固体催化剂,在固体催化剂表面分解NO的过程如下图所示。从吸附到解吸的过程中,能量状态最低的是___________(填字母序号)。
(2)为减少汽车尾气中NOx的排放,常采用CxHy(烃)催化还原NOx消除氮氧化物的污染。
例如:①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
②CH4(g)+4NO(g)=2N2 (g)+CO2 (g)+2H2O(g) △H2=-1160 kJ/mol
③CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H3
则△H3=___________。
(3)亚硝酰氯(ClNO)是有机合成中常用试剂,已知:2NO(g)+Cl2(g)![]() 2 ClNO(g) △H<0
2 ClNO(g) △H<0
①一定温度下,将2 molNO与2 molCl2置于2L密闭容器中发生反应,若该反应4min后达平衡,此时压强是初始的0.8倍,则平均反应速率v(Cl2)=___________mol·L-1·min-1。下列可判断反应达平衡状态的是___________(项序号字母)。
A 混合气体的平均相对分子质量不变
B 混合气体密度保持不变
C NO和Cl2的物质的量之比保持不变
D 每消耗1 moI NO同时生成1molClNO
②为了加快化学反应速率,同时提高NO的转化率,其他条件不变时,可采取的措施有___________(填选项序号字母)。
A 升高温度 B 缩小容器体积
C 再充入Cl2气体 D 使用合适的催化剂
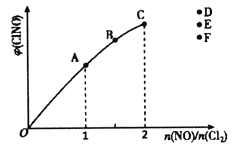
③一定条件下在恒温恒容的密闭容器中,按一定比例充入NO(g)和Cl2(g),平衡时ClNO的体积分数随n(NO)/n(Cl2)的变化图像如图(b)所示,当n(NO)/n(Cl2)=2.5时,达到平衡状态,ClNO的体积分数可能是图中D、E、F三点中的___________点。
(4)已知2NO(g)+O2(g)![]() 2NO2(g)的反应历程分两步:
2NO2(g)的反应历程分两步:
①2NO(g)![]() N2O2(g)(快),v1正=k1正c2(NO),v1逆 =k1逆c (N2O2)
N2O2(g)(快),v1正=k1正c2(NO),v1逆 =k1逆c (N2O2)
②N2O2(g)+O2(g)![]() 2NO2(g)(慢),v2正=k2正c(N2O2)·c(O2),v2逆=k2逆c2(NO2)
2NO2(g)(慢),v2正=k2正c(N2O2)·c(O2),v2逆=k2逆c2(NO2)
比较反应①的活化能E1与反应②的活化能E2的大小:E1___________E2(填“>”、"<”或“=”):2NO(g)+O2(g)![]() 2NO2(g)的平衡常数K与上述反应速率常数k1正、k1逆、k2正、k2逆的关系式为___________。
2NO2(g)的平衡常数K与上述反应速率常数k1正、k1逆、k2正、k2逆的关系式为___________。
【答案】C -867 kJ/mol 0.1 A, C B,C F < K = (k1正×K2正)/ (k1逆×K2逆)
【解析】
(1)结合固体催化剂的机理图解答,整个反应为N2(g)+O2(g) ![]() 2NO(g)△H=-181.5 kJ·mol-1,并根据焓变来解答;
2NO(g)△H=-181.5 kJ·mol-1,并根据焓变来解答;
(2)根据盖斯定律计算△H3;
(3) ① 利用“三段式”计算反应速率,根据平衡标志分析是否达到平衡状态;②根据影响反应速率的因素和影响平衡移动的因素分析;③投料比等于系数比时,达到平衡状态ClNO的体积分数最大;
(4) ① 反应速率越快活化能越小;
②根据反应达平衡状态时v1正=v1逆、v2正=v2逆计算;
(1)①从机理图可以看出,首先A状态中,NO被吸附到催化剂表面,B状态为NO变成N原子和O原子,这个过程需要吸收能量,C状态为N原子和N原子结合变成N2,O原子和O原子结合变成O2,这个过程为成键过程,需要放出能量,则从整个反应过程来看,反应是N2(g)+O2(g) ![]() 2NO(g)△H=-181.5 kJ·mol-1,此反是放热反应,反应焓变△H<0,可见状态C时体系能量最低。
2NO(g)△H=-181.5 kJ·mol-1,此反是放热反应,反应焓变△H<0,可见状态C时体系能量最低。
(2)①CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g) △H1=-574 kJ/mol
②CH4(g)+4NO(g)=2N2 (g)+CO2 (g)+2H2O(g) △H2=-1160 kJ/mol
①×![]() +②×
+②×![]() 得CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H3=-867 kJ/mol。
得CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H3=-867 kJ/mol。
(3) 2NO(g)+Cl2(g)![]() 2 ClNO(g)
2 ClNO(g)
开始 1 1 0
转化 2x x 2x
平衡 1-2x 1-x 2x
该反应4min后达平衡,此时压强是初始的0.8倍,所以![]() 解得x=0.4,则平均反应速率v(Cl2)=
解得x=0.4,则平均反应速率v(Cl2)=![]() 0.1 mol·L-1·min-1。
0.1 mol·L-1·min-1。
A.![]() ,气体总质量不变、气体物质的量是变量,所以混合气体的平均相对分子质量是变量,若混合气体的平均相对相对分子质量不变,一定达到平衡状态,故选A;
,气体总质量不变、气体物质的量是变量,所以混合气体的平均相对分子质量是变量,若混合气体的平均相对相对分子质量不变,一定达到平衡状态,故选A;
B.![]() ,容器体积不变、气体总质量不变,密度是恒量,混合气体密保持不变,不一定平衡,故不选B;
,容器体积不变、气体总质量不变,密度是恒量,混合气体密保持不变,不一定平衡,故不选B;
C.NO和Cl2的物质的量之比为![]() ,NO和Cl2的物质的量之比是变量,若保持不变一定平衡,故选C;
,NO和Cl2的物质的量之比是变量,若保持不变一定平衡,故选C;
D.每消耗1 mol NO同时生成1molClNO,不能判断正逆反应速率是否相等,不一定平衡,故不选D;选AC。
②A.2NO(g)+Cl2(g)![]() 2 ClNO(g)正反应放热,升高温度,平衡逆向移动,NO转化率减小,故不选A;
2 ClNO(g)正反应放热,升高温度,平衡逆向移动,NO转化率减小,故不选A;
B.缩小容器体积,压强增大,速率加快、平衡正向移动,NO转化率增大,故选B;
C.再充入Cl2气体,氯气浓度增大,速率加快、平衡正向移动,NO转化率增大,故选C;
D.使用合适的催化剂,平衡不移动,NO转化率不变,故不选D。
③n(NO)/n(Cl2)=2时,达到平衡状态ClNO的体积分数最大,当n(NO)/n(Cl2)=2.5时,达到平衡状态,ClNO的体积分数可能是图中F点
(4) ①因为决定2NO(g)+O2(g)![]() 2NO2(g)速率的是反应②,所以反应①的活化能E1远小于反应②的活化能E2;
2NO2(g)速率的是反应②,所以反应①的活化能E1远小于反应②的活化能E2;
②![]() ,反应达平衡状态时v1正=v1逆、v2正=v2逆,即k1正c2(NO) =k1逆c(N2O2)、k2正c(N2O2)·c(O2)=k2逆c2(NO2);带入
,反应达平衡状态时v1正=v1逆、v2正=v2逆,即k1正c2(NO) =k1逆c(N2O2)、k2正c(N2O2)·c(O2)=k2逆c2(NO2);带入![]() 得,K=(k1正×K2正)/(k1逆×K2逆)。
得,K=(k1正×K2正)/(k1逆×K2逆)。

 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案