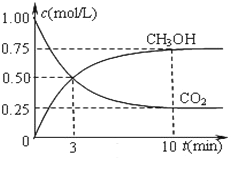
题目内容
【题目】二氧化硫一空气质子交换膜燃料电池将化学能转变成电能的同时,实现了制硫酸、发电、环保三位一体的结合,其原理如图所示。下列说法错误的是

A. 负极的电极反应式为SO2+2H2O-2e-=SO42-+4H+
B. 反应总式为2SO2+O2+2H2O=2H2SO4
C. 质子的移动方向为从电极B到电极A
D. SO2气流速度的大小可能影响电池的电动势
【答案】C
【解析】
A. A极通入SO2,SO2在负极失电子生成SO42-,则电极反应为SO2+2H2O-2e-=SO42-+4H+,故A正确;
B.该电池的反应原理为二氧化硫与氧气的反应,反应总式为2SO2+O2+2H2O=2H2SO4,故B正确;
C. A为负极,B为正极,质子的移动方向为从电极A到电极B,故C错误;
D.反应物的浓度大,反应速率快,SO2气流速度的大小可能影响电池的电动势,故D正确;
故选C。

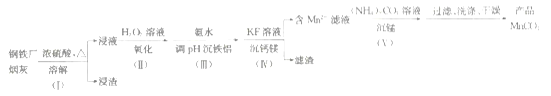
【题目】一种利用钢铁厂烟灰(含Fe、Mn、SiO2,少量的Al2O3、CaO及MgO)制备MnCO3的工艺流程如下:
已知25℃时,下列难溶物的溶度积常数:
难溶物 | CaF2 | MgF2 | MnCO3 | Mn(OH)2 |
Ksp | 4.0×10-11 | 6.4×10-9 | 2.2×10-11 | 1.9×10-13 |
回答下列问题:
(1)步骤(Ⅰ)浸渣的主要成分是______________(填化学式)。
(2)步骤(Ⅱ)加H2O2溶液时反应的离子方程式为________________;
加氨水调节pH沉铁铝时,步骤(Ⅲ)应调节的pH适宜范围为____________。(部分金属离子开始沉淀与沉淀完全的pH范围如下)
金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Mg2+ |
沉淀pH范围 | 7.6~9.6 | 2.7~3.7 | 3.4~5.2 | 8.3~9.3 | 9.6~11.1 |
(3)步骤(Ⅳ)用KF溶液沉钙镁时,要使c(Ca2+)、c(Mg2+)均小于1×10-6mol·L-1,则应控制反应液中c(F-)>___________mol·L-1;反应MgF2(s)+Ca2+![]() CaF2(s)+Mg2+的平衡常数K=___________。
CaF2(s)+Mg2+的平衡常数K=___________。
(4)步骤Ⅴ沉锰时,在60℃按投料比n[(NH4)2CO3]/n(Mn2+)=2,溶液的pH对MnCO3产率的影响如图所示;pH=7,按投料比n[(NH4)2CO3]/n(Mn2+)=2,反应温度对MnCO3产率的影响如图所示。
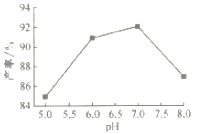
①上图中,在pH<7.0时,pH越小产率____________(填“越高”或“越低”;在pH>7.0时,pH越大产率越低且纯度也降低,其原因是___________________。

②上图中,温度高于60℃时,温度越高产率越低且纯度也越低,主要原因是______________。