题目内容
【题目】某反应中反应物与生成物有:浓H2SO4、K2S、K2SO4、SO2、H2O和一种未知物质X。
(1)已知K2S在反应中失去电子,则该反应的氧化剂是_____,_____被氧化。
(2)已知0.5molK2S在反应中失去1mol电子生成X,则X的化学式为_____。
(3)按还原剂和氧化剂顺序将反应物填入下列空格中,配平,并标出电子转移的方向和数目:
![]() ___________________
___________________
(4)若反应中浓H2SO4过量,则产物中无X生成,请完成此反应的化学方程式:_____。在上述过程中,若有0.4mol浓硫酸被还原,反应中转移电子的物质的量为_____mol。
【答案】浓硫酸 K2S S 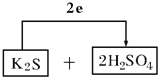 4H2SO4(浓)+K2S=K2SO4+4SO2↑+4H2O 0.8
4H2SO4(浓)+K2S=K2SO4+4SO2↑+4H2O 0.8
【解析】
(1)已知K2S在反应中失去电子硫元素化合价升高,则该反应的氧化剂为浓硫酸,硫元素化合价降低;
(2)已知0.5molK2S在反应中失去1mol电子生成X,浓硫酸被还原为二氧化硫,结合电子守恒计算分析硫元素化合价;
(3)计算得到K2S被氧化为S,浓硫酸被还原为SO2,电子转移依据元素化合价变化计算得到2e﹣;
(4)若反应中浓H2SO4过量产物中无S生成,说明硫化钾被氧化为二氧化硫,利用化学方程式定量关系计算若有0.4mol浓硫酸被还原,反应中转移电子的物质的量。
(1)反应物与生成物有:浓H2SO4、K2S、K2SO4、SO2、H2O和一种未知物质X,已知K2S在反应中失去电子硫元素化合价升高,则该反应的氧化剂为浓硫酸,硫元素化合价降低,K2S中硫元素化合价升高被氧化生成S;
故答案为:浓硫酸;K2S;
(2)已知0.5molK2S在反应中失去1mol电子生成X硫元素化合价为x,浓硫酸被还原为二氧化硫,结合电子守恒计算分析硫元素化合价,[x﹣(﹣2)]×0.5mol=1,x=0,则生成的X为S,
故答案为:S;
(3)计算得到K2S被氧化为S,浓硫酸被还原为SO2,电子转移依据元素化合价变化和电子守恒计算得到2e﹣,则氧化剂为浓硫酸和还原剂为K2S,配平后系数填入空格中,标出电子转移的方向和数目为: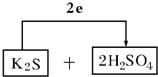 ;
;
故答案为: ;
;
(4)若反应中浓H2SO4过量产物中无S生成,同种元素不同价态间发生氧化还原反应最大程度发生归中反应,说明硫化钾被氧化为二氧化硫,反应的化学方程式为:4H2SO4(浓)+K2S=K2SO4+4SO2↑+4H2O,在上述过程中,3mol硫酸被还原,电子转移6mol电子,若有0.4mol浓硫酸被还原,反应中转移电子的物质的量为0.8mol;
故答案为:4H2SO4(浓)+K2S=K2SO4+4SO2↑+4H2O;0.8。





