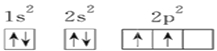
题目内容
【题目】某校科学兴趣小组探究二氧化碳与过氧化钠反应是否有氧气生成,设计了如图的实验装置.B中盛有饱和碳酸氢钠溶液,目的是除去二氧化碳中混有的氯化氢气体,E为收集氧气装置.
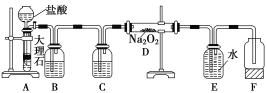
(1)写出装置A中发生反应的化学方程式____________。
(2)C中盛有____________,目的是_____________。
(3)写出装置D中发生反应的化学方程式__________。
(4)指出装置E的错误_________。
【答案】 CaCO3+2HCl=CaCl2+H2O+CO2↑ 浓硫酸 除去二氧化碳年中混有的水蒸气 2Na2O2+2CO2=2Na2CO3+O2 导气管应长进短出
【解析】由题中信息可知,该兴趣小组首先用大理石和盐酸反应制取二氧化碳,然后用饱和碳酸氢钠溶液除去二氧化碳中的杂质氯化氢,接着经C装置将二氧化碳干燥后再通入D与过氧化钠反应,用E排水集气收集产生的氧气,F用来承接E排出的水。
(1)装置A中发生反应的化学方程式CaCO3+2HCl=CaCl2+H2O+CO2↑。
(2)干燥二氧化碳常用的液体干燥剂是浓硫酸,所以C中盛有浓硫酸,目的是除去二氧化碳年中混有的水蒸气。
(3)装置D中发生反应的化学方程式2Na2O2+2CO2=2Na2CO3+O2。
(4)排水集气,导气管应短进长出,装置E的错误是导气管长进短出,这样只能收集到很少的气体。

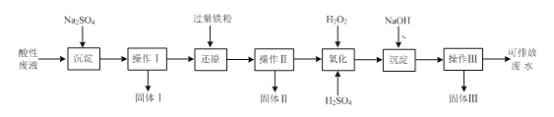
【题目】一种利用钢铁厂烟灰(含Fe、Mn、SiO2,少量的Al2O3、CaO及MgO)制备MnCO3的工艺流程如下:
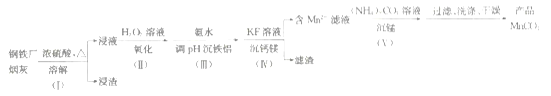
已知25℃时,下列难溶物的溶度积常数:
难溶物 | CaF2 | MgF2 | MnCO3 | Mn(OH)2 |
Ksp | 4.0×10-11 | 6.4×10-9 | 2.2×10-11 | 1.9×10-13 |
回答下列问题:
(1)步骤(Ⅰ)浸渣的主要成分是______________(填化学式)。
(2)步骤(Ⅱ)加H2O2溶液时反应的离子方程式为________________;
加氨水调节pH沉铁铝时,步骤(Ⅲ)应调节的pH适宜范围为____________。(部分金属离子开始沉淀与沉淀完全的pH范围如下)
金属离子 | Fe2+ | Fe3+ | Al3+ | Mn2+ | Mg2+ |
沉淀pH范围 | 7.6~9.6 | 2.7~3.7 | 3.4~5.2 | 8.3~9.3 | 9.6~11.1 |
(3)步骤(Ⅳ)用KF溶液沉钙镁时,要使c(Ca2+)、c(Mg2+)均小于1×10-6mol·L-1,则应控制反应液中c(F-)>___________mol·L-1;反应MgF2(s)+Ca2+![]() CaF2(s)+Mg2+的平衡常数K=___________。
CaF2(s)+Mg2+的平衡常数K=___________。
(4)步骤Ⅴ沉锰时,在60℃按投料比n[(NH4)2CO3]/n(Mn2+)=2,溶液的pH对MnCO3产率的影响如图所示;pH=7,按投料比n[(NH4)2CO3]/n(Mn2+)=2,反应温度对MnCO3产率的影响如图所示。
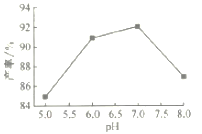
①上图中,在pH<7.0时,pH越小产率____________(填“越高”或“越低”;在pH>7.0时,pH越大产率越低且纯度也降低,其原因是___________________。
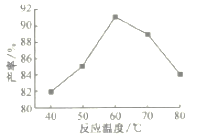
②上图中,温度高于60℃时,温度越高产率越低且纯度也越低,主要原因是______________。