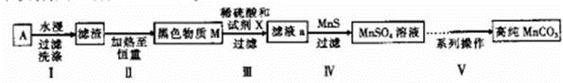
题目内容
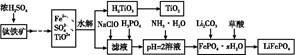
电子级钴的氧化物用于半导体工业和电子陶瓷等领域,是一种纯度很高的氧化物。其工业制取流程如下:
(1)实验室过滤所需的仪器有铁架台、铁圈、烧杯、 和漏斗。
(2)滤渣A的成分除过量的Co3(PO4)3和Fe(OH)3外还有 (填化学式),加入CO3(PO4)2的目的是 。
(3)Co与稀硝酸反应生成 Co2+的离子方程式为: 。
(4)滤渣B经过反复洗涤、干燥后,进行灼烧,其热重分析图如下:写出下列化学反应方程式: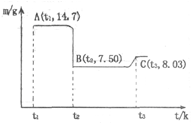
①AB段: ;
②BC段 。
(1)玻璃棒(2)Si 调节pH,保证Co2+不沉淀,而使铁离子全部沉淀
(3)3Co+8H++2NO3-=3Co2++4H2O+2NO↑
(4)CoC2O4 CoO+CO↑+CO2↑ 6CoO+O2
CoO+CO↑+CO2↑ 6CoO+O2 2Co3O4
2Co3O4
解析试题分析:(1)实验室过滤所需的仪器有铁架台、铁圈、烧杯、玻璃棒和漏斗。(2)在加入硝酸酸化时钴、Fe都与硝酸发生反应得到硝酸钴、硝酸铁而Si不能与稀硝酸发生反应,所以过滤后存在于滤渣A中。因此滤渣A的主要成分除过量的Co3(PO4)3和Fe(OH)3外还有Si。加入CO3(PO4)2的目的是调节pH,保证Co2+不沉淀,而使铁离子全部沉淀。(3)Co与稀硝酸反应生成 Co2+,根据质量守恒定律和电子守恒、电荷守恒,可知该反应的离子方程式为3Co+8H++2NO3-=3Co2++4H2O+2NO↑。(4)滤渣B(CoC2O4)灼烧发生分解反应:CoC2O4 =CoO+CO↑+CO2↑。得到固体为CoO。n(CoC2O4)=14.7g÷147g/mol=0.1mol;根据元素守恒可得m(CoO)=0.1mol×75g/mol=7.5g;而在t3时固体的质量为8.03g.根据质量守恒定律可知在BC段发生了反应:6CoO+O2
=CoO+CO↑+CO2↑。得到固体为CoO。n(CoC2O4)=14.7g÷147g/mol=0.1mol;根据元素守恒可得m(CoO)=0.1mol×75g/mol=7.5g;而在t3时固体的质量为8.03g.根据质量守恒定律可知在BC段发生了反应:6CoO+O2 2Co3O4。
2Co3O4。
考点:考查混合物的分离方法、试剂的使用、化学方程式离子方程式的书写及有关计算的知识。

下列物质能用于萃取溴水中的溴的是
| A.直馏汽油 | B.裂化汽油 | C.酒精 | D.己烷 |
有一无色透明溶液,欲确定是否含有下列离子: Fe2+、Mg2+、Al3+、Ba2+、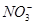 、
、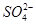 、Cl-、I-、
、Cl-、I-、 ,取该溶液进行实验:
,取该溶液进行实验:
| 实验步骤 | 实验现象 |
| (1)取少量该溶液,加几滴紫色石蕊试液 | 溶液变红 |
| (2)取少量该溶液加热,加Cu片和浓H2SO4,加热 | 有无色气体产生,气体遇空气变成红棕色 |
| (3)取少量该溶液,加BaCl2溶液 | 有白色沉淀 |
| (4)取(3)中上层清液,加AgNO3溶液 | 有白色沉淀,且不溶于稀HNO3 |
| (5)取少量该溶液,加NaOH溶液 | 有白色沉淀,NaOH过量时沉淀部分溶解 |
由此判断:
(1)溶液中肯定不存在的离子有 ,溶液中肯定存在的离子是 。
(2)请设计实验验证其中可能存在的阴离子的方法(写明操作、现象、结论) 。
铬铁矿的主要成分可表示为FeO·Cr2O3,还含有SiO2、Al2O3等杂质,以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的过程如下图所示。
已知:① NaFeO2遇水强烈水解。
② Cr2O72-+ H2O 2CrO42-+ 2H+
2CrO42-+ 2H+
(1)K2Cr2O7中Cr元素的化合价是 。
(2)滤液1的成分除Na2CrO4、Na2SiO3外,还含有(填化学式) ;
生成滤渣1中红褐色物质反应的化学方程式是。
(3)由滤液2转化为Na2Cr2O7溶液应采取的措施是。
(4)煅烧铬铁矿生成Na2CrO4和NaFeO2反应的化学方程式是 。
(5)莫尔法是一种沉淀滴定法,以Na2CrO4 为指示剂,用标准硝酸银溶液滴定待测液,进行测定溶液中Cl-的浓度。已知:
| 银盐 性质 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| Ksp | 1.34×10-6 | 7.1×10-7 | 1.1×10-8 | 6.5×10-5 | 1.0×10-6 |
①滴定终点的现象是。
②若用AgNO3溶液滴定NaSCN溶液,可选为滴定指示剂的是(选填编号)
A.NaCl B.K2CrO4 C.BaBr2

 、乙醇)
、乙醇)