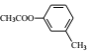
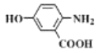
题目内容
【题目】下列说法正确的是
A.燃烧热的数值都会随反应物的用量不同而改变,故1mol S(s)和2mol S(s)的燃烧热不相等
B.已知:2C(s)+2O2(g)=2CO2(g)ΔH=akJ/mol;2C(s)+2O2(g)=2CO(g)ΔH=bkJ/mol 则a>b
C.H2(g)的燃烧热为285.8kJ/mol,则表示H2燃烧热的热化学方程式为:2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ/mol
D.反应NH4HCO3(s)=NH3(g)+H2O(g)+CO2(g) ΔH=+185.57kJ/mol,在低温条件下不能自发进行,但在高温条件下能自发进行
【答案】D
【解析】
A. 在25℃、101 kPa时,1 mol 纯物质完全燃烧生成稳定的氧化物时所放出的热量,叫做该物质的燃烧热,故1mol S(s)和2mol S(s)的燃烧热相等,A项错误;
B.由选项知,碳燃烧生成一氧化碳放热少,焓变是负值比较大,则a<b,B项错误;
C. H2(g)的燃烧热为285.8kJ/mol,则表示H2燃烧热的热化学方程式为: H2(g)+![]() O2(g)= H2O(l) ΔH=-285.8kJ/mol,C项错误;
O2(g)= H2O(l) ΔH=-285.8kJ/mol,C项错误;
D.该反应ΔH=+185.57kJ/mol>0,ΔS>0,又ΔG=ΔH-TΔS,则推知在低温条件下不能自发进行,但在高温条件下能自发进行,D项正确;
故选D。

【题目】下列图象中,纵坐标为沉淀物的量,横坐标为溶液中加入反应物的物质的量,试按题意将图象中相应的数字序号填入表中的顺序为
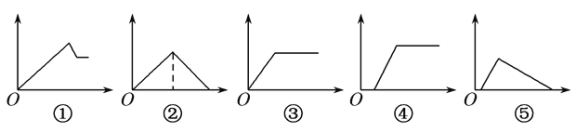
溶液 | 加入物质 | 相应序号 |
(1)氯化铝溶液 | 加入过量氨水 | |
(2)饱和澄清石灰水 | 通入过量CO2气体 | |
(3)含少量NaOH的偏铝酸钠溶液 | 通入过量CO2气体 | |
(4)含少量NaOH的偏铝酸钠溶液 | 逐滴加入稀盐酸 | |
(5)MgCl2、AlCl3的混合溶液 | 逐滴加入NaOH溶液至过量 |
A. ①③②④⑤ B. ③⑤④②①
C. ①②③④⑤ D. ③②④⑤①