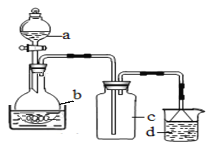
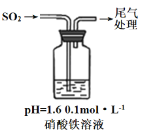
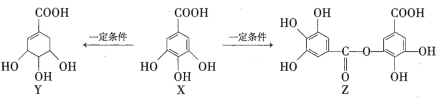
题目内容
【题目】海洋是一个资源宝库,海水资源的开发和利用是现代和未来永恒的主题。下面是海水利用的流程图:
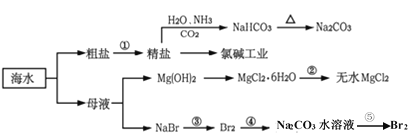
下列有关说法不正确的是
A.过程中制得NaHCO3是先往精盐溶液中通入CO2,再通入NH3
B.氯碱工业在阳极产生了使湿润淀粉碘化钾试纸变蓝的气体
C.反应②加热MgCl2·6H2O应在HCl气流保护下制备无水MgCl2
D.反应⑤中,用Na2CO3水溶液吸收Br2后,用70—80%硫酸富集Br2
【答案】A
【解析】
A. 先通入氨气可增大二氧化碳的溶解度,则通入气体的顺序不合理,A项错误;
B. 氯碱工业在阳极上氯离子放电生成氯气,使湿润淀粉碘化钾试纸变蓝,B项正确;
C. 加热促进镁离子水解,且生成盐酸易挥发,应在HCl气流中蒸发制备,C项正确;
D. 用纯碱吸收溴,主要反应是3Br2+3Na2CO3=5NaBr+NaBrO3+3CO2↑,生成的NaBr、NaBrO3与硫酸反应,得到Br2,达到富集目的,D项正确;
答案选A。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目