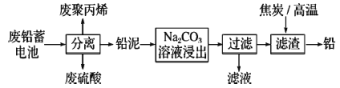
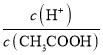题目内容
【题目】下列叙述正确的是
A.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中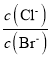 增大
增大
B.在0.1 mol/LCH3COONa溶液中:c(OH﹣)+0.1mol/L>c(CH3COOH)+c(H+)+c(Na+)
C.在10mL 0.1 mol/L的AgNO3溶液中加入6mL等浓度的NaCl溶液,有白色沉淀产生,再加入6 mL等浓度的Na2S溶液,溶液中又有黑色沉淀生成,说明Ksp(Ag2S)< Ksp(AgCl)
D.常温下,10 mL 0.02 mol/L HCl溶液与10 mL 0.02 mol/LBa(OH)2溶液充分混合,若混合后溶液的体积为20 mL,则溶液的pH=12
【答案】D
【解析】
A. 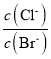 =
=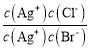 =
=![]() ,则溶液中
,则溶液中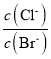 不变,A项错误;
不变,A项错误;
B.由电荷守恒和物料守恒知c(H+)+c(Na+)= c(OH﹣)+ c(CH3COO﹣),c(CH3COO﹣)+ c(CH3COOH)= 0.1mol/L,则c(OH﹣)+0.1mol/L-[c(CH3COOH)+c(H+)+c(Na+)]= c(OH﹣)+0.1mol/L-[c(CH3COOH)+ c(OH﹣)+ c(CH3COO﹣)]= 0.1mol/L-[c(CH3COOH) + c(CH3COO﹣)]=0,B项错误;
C.由于不知NaCl溶液浓度,则不能确定AgNO3溶液是否被反应完,所以不能判断黑色沉淀Ag2S来自于AgCl与硫化钠的反应,还是AgNO3与硫化钠的反应,C项错误;
D. 常温下,10 mL 0.02 mol/L (即2×10-4mol)HCl溶液与10 mL 0.02 mol/L(即2×10-4mol)Ba(OH)2溶液充分混合,根据反应方程式2HCl + Ba(OH)2 = BaCl2 + 2H2O,可知反应后溶液为1×10-4mol Ba(OH)2和1×10-4mol BaCl2,则混合后c(OH-)=![]() =0.01mol/L,pH=-
=0.01mol/L,pH=-![]() =-
=-![]() =12,D项正确;
=12,D项正确;
故选D。

 互动课堂系列答案
互动课堂系列答案 激活思维智能训练课时导学练系列答案
激活思维智能训练课时导学练系列答案