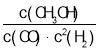题目内容
【题目】研究减少CO2排放是一项重要课题。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应Ⅰ:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-49.6 kJ/mol
CH3OH(g)+H2O(g) △H1=-49.6 kJ/mol
反应Ⅱ:CH3OCH3(g)+H2O(g) ![]() 2CH3OH(g) △H2=+23.4 kJ/mol
2CH3OH(g) △H2=+23.4 kJ/mol
反应Ⅲ:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) △H3
CH3OCH3(g)+3H2O(g) △H3
(1)△H3=________kJ/mol。
(2)恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,发生反应I。下列描述能说明反应I达到平衡状态的是_______(填序号)。
A.反应体系总压强保持不变
B.容器内的混合气体的密度保持不变
C.水分子中断裂2NA个H-O键,同时氢分子中断裂3NA个H-H键
D.CH3OH和H2O的浓度之比保持不变
(3)反应II在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下:
物质 | CH3OCH3(g) | H2O(g) | CH3OH(g) |
浓度/mol·L-1 | 1.8 | 1.8 | 0.4 |
此时v正___v逆(填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH体积分数(CH3OH)% =___%。
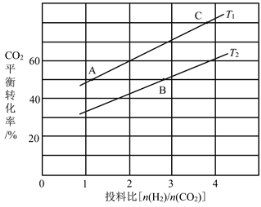
(4)在某压强下,反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6mol CO2和12mol H2充入2 L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=____;KA、KB、KC三者之间的大小关系为____。
(5)恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应I和反应III,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。其中:CH3OH的选择性=![]() ×100%
×100%

在上述条件下合成甲醇的工业条件是____。
A.210℃ B.230℃ C.催化剂CZT D.催化剂CZ(Zr-1)T
【答案】-122.6 AC > 20 0.18mol·L1·min1 KA=KC>KB BD
【解析】
(1)反应Ⅰ:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-49.6 kJ/mol
CH3OH(g)+H2O(g) △H1=-49.6 kJ/mol
反应Ⅱ:CH3OCH3(g)+H2O(g) ![]() 2CH3OH(g) △H2=+23.4 kJ/mol
2CH3OH(g) △H2=+23.4 kJ/mol
反应Ⅲ:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) △H3
CH3OCH3(g)+3H2O(g) △H3
通过盖斯定律计算△H3=2△H1-△=-49.6 kJ/mol×2-23.4 kJ/mol =-122.6 kJ/mol,
故答案为:-122.6 kJ/mol;
(2)A.该反应属于气体体积变化的反应,所以压强不变属于平衡,故A正确;
B.容器内的混合气体的密度等于质量除以体积,反应前后质量与体积都不变,故密度是个不变量,故B错误;
C.水分子中断裂2NA个H-O键,同时氢分子中断裂3NA个H-H键,速率之比等于化学计量数之比,且方向相反,故C正确;
D.CH3OH和H2O的浓度之比保持不变 ,相当于两者之比等于1:1,不能说明平衡状态,故D错误;
故答案为:AC ;
(3)在CH3OCH3(g)+H2O(g) ![]() 2CH3OH(g) 中,根据Qc=(CH3OH)2/(CH3OCH3)(H2O)=0.42/1.8×1.8<0.25,说明平衡正向移动,故此时v正>v逆
2CH3OH(g) 中,根据Qc=(CH3OH)2/(CH3OCH3)(H2O)=0.42/1.8×1.8<0.25,说明平衡正向移动,故此时v正>v逆
CH3OCH3(g)+H2O(g) ![]() 2CH3OH(g)
2CH3OH(g)
起始 1.8 1.8 0.4
反应 x x 2x
平衡 1.8-x 1.8-x 0.4+2x
根据K=( 0.4+2x)(0.4+2x)/(1.8-x)( 1.8-x )=0.25,混合气体中CH3OH体积分数(CH3OH)% =(1.8-x )/( 1.8-x+1.8-x +0.4+2x)= 20 % ,
故答案为:20;
(4)2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g)
CH3OCH3(g)+3H2O(g)
起始(mol) 6 12 0 0
反应(mol) 2x 6x x 3x
平衡(mol) 6-2x 12-6x x 3x
根据CO2的平衡转化率,T1温度下CO2的转化率为60% ,所以有2x/6=0.6,解得x=1.8,故0~5min内的平均反应速率v(CH3OCH3) =1.8mol÷2L÷5min= 0.18mol·L1·min1 ;
化学平衡常数只与温度有关,放热反应呈反比,所以KA、KB、KC三者之间的大小关系为KA=KC>KB ;
故答案为: 0.18mol·L1·min1 ;KA=KC>KB ;
(5)根据上图转化率与本题要求,合成甲醇的工业条件要求“多快好省” ,选择合适的温度和合适的催化剂,故选择230℃和催化剂CZ(Zr-1)T ,
故答案为:BD

 口算能手系列答案
口算能手系列答案【题目】北京市场销售的某种食用精制盐包装袋上有如下说明:
产品标准 | GB5461 |
产品等级 | 一级 |
配 料 | 食盐、碘酸钾、抗结剂 |
碘含量(以I计) | 20~50mg/kg |
分装时期 | |
分装企业 |
(1)碘酸钾与碘化钾在酸性条件下发生如下反应,配平化学方程式(将化学计量数填于空白处)
____KIO3+___KI+___H2SO4=___K2SO4+___I2+___H2O
(2)上述反应生成的I2可用四氯化碳检验。向碘的四氯化碳溶液中加入Na2SO3稀溶液,将I2还原,以回收四氯化碳。
①Na2SO3稀溶液与I2反应的离子方程式是_________________________________。
②某学生设计回收四氯化碳的操作步骤为:
a.将碘的四氯化碳溶液置于分液漏斗中;
b.加入适量Na2SO3稀溶液;
c.分离出下层液体。
以上设计中遗漏的操作及在上述步骤中的位置是______________________。
(3)已知:I2+2S2O32-=2I-+S4O62-。某学生测定食用精制盐的碘含量,其步骤为:
a. 准确称取wg食盐,加适量蒸馏水使其完全溶解;
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全;
c.以淀粉为指示剂,逐滴加入物质的量浓度为2.0×10-3mol·L-1的Na2S2O3溶液10.0mL,恰好反应完全。
①判断c中反应恰好完全依据的现象是______________________。
②b中反应所产生的I2的物质的量是___________mol。
③根据以上实验和包装袋说明,所测精制盐的碘含量是(以含w的代数式表示)
_______________________mg/kg。
【题目】酸碱中和滴定是中学化学常见实验。
Ⅰ.下图表示50mL酸式滴定管中液面的位置,如果液面处的读数是a,则滴定管中剩余液体的体积是______mL。
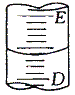
A、a B、大于a C、小于(50-a) D、大于(50-a)
Ⅱ.某同学欲测定某浓硫酸样品的物质的量浓度,进行了以下实验操作:
A 冷却至室温后,在100mL容量瓶中定容配成100mL稀硫酸。
B 量取20.00mL稀硫酸于锥形瓶中并滴入几滴指示剂。
C 将酸式滴定管和碱式滴定管用蒸馏水洗涤干净,并用各待盛溶液润洗。
D 将物质的量浓度为1.50 mol·L-1的标准NaOH溶液装入碱式滴定管,调节液面记下读数V1。
E 继续滴定至终点,记下读数为V2。
F 在锥形瓶下垫一张白纸,把锥形瓶移到碱式滴定管下小心滴入NaOH标准溶液,边滴边摇动锥形瓶。
G 量取浓硫酸样品5 mL,在烧杯中用蒸馏水溶解。
H 重复以上实验。
请回答下列问题:
(1)该实验正确操作步骤的顺序为____→ A →_____→_____→D→_____→_____→ H(用编号字母填写)。
(2)量取5mL浓硫酸的仪器是________________________;量取20.00mL稀硫酸的仪器是_________。
(3)选用的指示剂是_____________。滴定过程中,视线应注视____________________;判断到达滴定终点的现象是________________;读数时,视线应____________(填“高于”、“低于”或“相平于”)溶液凹液面的最低处。
(4)下表是实验测得的有关数据:
滴定序号 | 待测稀硫酸的体积(mL) | 所消耗NaOH标准溶液液的体积(mL) | |
V1 | V2 | ||
① | 20.00 | 0.50 | 22.60 |
② | 20.00 | 6.00 | 27.90 |
请计算出该浓硫酸样品的浓度为____________mol·L-1 (不必写出计算过程)。
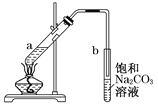
【题目】除去下列物质中所含杂质(括号中的物质)所选用的试剂和装置均正确的是 ( )
Ⅰ.试剂:①KMnO4/H+②NaOH溶液 ③饱和Na2CO3溶液④H2O ⑤Na ⑥Br2/H2O ⑦Br2/CCl4
Ⅱ.装置:

选项 | 物质 | 试剂 | 装置 |
A | C2H6(C2H4) | ⑥ | ① |
B | 苯(苯酚) | ① | ③ |
C | CH3COOC2H5(CH3COOH) | ③ | ② |
D | 甲苯(二甲苯) | ① | ③ |