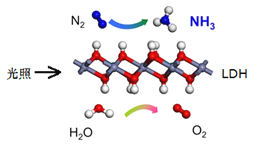
题目内容
【题目】一定温度下,某反应达到平衡,平衡常数K=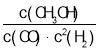 。恒容时,温度升高,H2浓度增大。下列说法正确的是( )
。恒容时,温度升高,H2浓度增大。下列说法正确的是( )
A. 该反应的化学方程式为CH3OH![]() CO+2H2
CO+2H2
B. 使用催化剂,H2浓度一定减小
C. 升高温度,逆反应速率减小
D. 该反应的焓变(ΔH)为负值
【答案】D
【解析】
试题化学常数是在一定条件下的可逆反应中,当可逆反应反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据平衡常数的表达式可知,该反应的方程式是CO+2H2![]() CH3OH,A不正确;催化剂不能影响平衡状态,B不正确;升高温度正逆反应速率都是增大的,C不正确;恒容时,温度升高,H2浓度增大,这说明升高温度平衡向逆反应方向移动,因此正反应是放热反应,答案选D。
CH3OH,A不正确;催化剂不能影响平衡状态,B不正确;升高温度正逆反应速率都是增大的,C不正确;恒容时,温度升高,H2浓度增大,这说明升高温度平衡向逆反应方向移动,因此正反应是放热反应,答案选D。

 新非凡教辅冲刺100分系列答案
新非凡教辅冲刺100分系列答案【题目】N2O5是一种新型硝化剂,其性质和制备受到人们的关注。已知N2O5能与水发生反应,并放出大量的热。
Ⅰ.一定温度下,在恒容密闭容器中N2O5发生下列反应:2N2O5(g)![]() 4NO2(g)+O2(g)ΔH。
4NO2(g)+O2(g)ΔH。
(1)下表为反应在T1温度下的部分实验数据:
t/s | 0 | 500 | 1000 |
c(N2O5)/mol·L—1 | 5.00 | 3.52 | 2.48 |
则500s内NO2的生成速率为______________。
(2)反应达到平衡后,若再通入一定量N2O5,达到新平衡时,N2O5的转化率将______(填“增大”、“减小”、“不变”)。
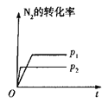
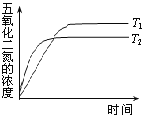
(3)在温度T1和T2时,N2O5的浓度与反应时间的关系如图所示。据此判断:T1______T2(填“>”、“<”或“=”,下同),ΔH______0。
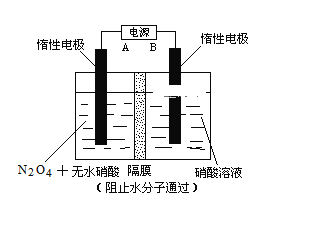
Ⅱ.下图所示装置,可用于制备N2O5气体。A是电源的____________(填“负极”或“正极”),电解池的阳极反应式为______________________________________________________。
【题目】研究减少CO2排放是一项重要课题。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应Ⅰ:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-49.6 kJ/mol
CH3OH(g)+H2O(g) △H1=-49.6 kJ/mol
反应Ⅱ:CH3OCH3(g)+H2O(g) ![]() 2CH3OH(g) △H2=+23.4 kJ/mol
2CH3OH(g) △H2=+23.4 kJ/mol
反应Ⅲ:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) △H3
CH3OCH3(g)+3H2O(g) △H3
(1)△H3=________kJ/mol。
(2)恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,发生反应I。下列描述能说明反应I达到平衡状态的是_______(填序号)。
A.反应体系总压强保持不变
B.容器内的混合气体的密度保持不变
C.水分子中断裂2NA个H-O键,同时氢分子中断裂3NA个H-H键
D.CH3OH和H2O的浓度之比保持不变
(3)反应II在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下:
物质 | CH3OCH3(g) | H2O(g) | CH3OH(g) |
浓度/mol·L-1 | 1.8 | 1.8 | 0.4 |
此时v正___v逆(填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH体积分数(CH3OH)% =___%。
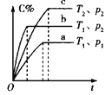
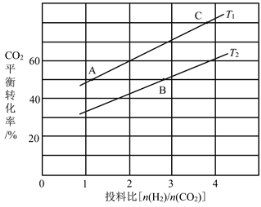
(4)在某压强下,反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6mol CO2和12mol H2充入2 L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=____;KA、KB、KC三者之间的大小关系为____。
(5)恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应I和反应III,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。其中:CH3OH的选择性=![]() ×100%
×100%

在上述条件下合成甲醇的工业条件是____。
A.210℃ B.230℃ C.催化剂CZT D.催化剂CZ(Zr-1)T