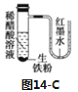
题目内容
【题目】(1)氯化铁水解的离子方程式为_________________________________,实验室配制氯化铁溶液时,常将氯化铁先溶于浓盐酸,然后再加水稀释,其目的是_________________________。
(2)若向氯化铁溶液中加入碳酸钙粉末,碳酸钙逐渐逐渐溶解,并产生无色气体的离子方程式为________,溶液中同时有红褐色沉淀生成,其原因是______________。
【答案】Fe3+ + 3H2O![]() Fe(OH)3 + 3H+ 抑制Fe3+的水解,以得到较为纯净的FeCl3溶液 CaCO3 + 2H+ = Ca2+ + H2O + CO2↑ CaCO3与H+反应,溶液中H+浓度降低,促使Fe3+的水解平衡向正方向移动,从而产生Fe(OH)3沉淀
Fe(OH)3 + 3H+ 抑制Fe3+的水解,以得到较为纯净的FeCl3溶液 CaCO3 + 2H+ = Ca2+ + H2O + CO2↑ CaCO3与H+反应,溶液中H+浓度降低,促使Fe3+的水解平衡向正方向移动,从而产生Fe(OH)3沉淀
【解析】
(1)FeCl3属于强酸弱碱盐,铁离子水解生成氢氧化铁和氢离子导致其溶液呈酸性,根据同离子效应对水解程度的影响作答;
(2)FeCl3水解生成的HCl能和碳酸钙反应生成氯化钙、二氧化碳和水。
(1)FeCl3属于强酸弱碱盐,铁离子在水溶液中发生部分水解,其离子方程式为Fe3+ + 3H2O![]() Fe(OH)3 + 3H+,加入酸后,溶液中氢离子浓度增大能抑制其水解,故答案为:Fe3+ + 3H2O
Fe(OH)3 + 3H+,加入酸后,溶液中氢离子浓度增大能抑制其水解,故答案为:Fe3+ + 3H2O![]() Fe(OH)3 + 3H+;
Fe(OH)3 + 3H+;
(2)水解生成的氯化氢能和碳酸钙反应生成氯化钙、二氧化碳和水,离子方程式为CaCO3 + 2H+ = Ca2+ + H2O + CO2↑;消耗氢离子,氢离子浓度降低从而促进氯化铁水解,最终生成氢氧化铁红褐色沉淀,故答案为:CaCO3 + 2H+ = Ca2+ + H2O + CO2↑ CaCO3与H+反应,溶液中H+浓度降低,促使Fe3+的水解平衡向正方向移动,从而产生Fe(OH)3沉淀。

【题目】某化学兴趣小组制取氯酸钾和氯水并进行有关探究实验。
实验一 制取氯酸钾和氯水
利用如图所示的实验装置进行实验。
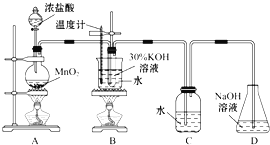
(1)制取实验结束后,取出B中试管冷却结晶,过滤,洗涤。该实验操作过程需要的玻璃仪器有______。
(2)若对调B和C装置的位置,_____(填“可能”或“不可能”)提高B中氯酸钾的产率。
实验二 氯酸钾与碘化钾反应的研究
(3)在不同条件下KClO3可将KI氧化为I2或KIO3。该小组设计了系列实验研究反应条件对反应产物的影响,其中系列a实验的记录表如下(实验在室温下进行):
试管编号 | 1 | 2 | 3 | 4 |
0.20molL-1KI/mL | 1.0 | 1.0 | 1.0 | 1.0 |
KClO3(s)/g | 0.10 | 0.10 | 0.10 | 0.10 |
6.0molL-1H2SO4/mL | 0 | 3.0 | 6.0 | 9.0 |
蒸馏水/mL | 9.0 | 6.0 | 3.0 | 0 |
实验现象 |
①系列a实验的实验目的是______。
②设计1号试管实验的作用是______。
③若2号试管实验现象是溶液变为黄色,取少量该溶液加入______溶液显蓝色。
实验三 测定饱和氯水中氯元素的总量
(4)根据下列资料,为该小组设计一个简单可行的实验方案(不必描述操作过程的细节):_____。
资料:①次氯酸会破坏酸碱指示剂;
②次氯酸或氯水可被SO2、H2O2和FeCl2等物质还原成Cl-。
【题目】研究减少CO2排放是一项重要课题。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应Ⅰ:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-49.6 kJ/mol
CH3OH(g)+H2O(g) △H1=-49.6 kJ/mol
反应Ⅱ:CH3OCH3(g)+H2O(g) ![]() 2CH3OH(g) △H2=+23.4 kJ/mol
2CH3OH(g) △H2=+23.4 kJ/mol
反应Ⅲ:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) △H3
CH3OCH3(g)+3H2O(g) △H3
(1)△H3=________kJ/mol。
(2)恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,发生反应I。下列描述能说明反应I达到平衡状态的是_______(填序号)。
A.反应体系总压强保持不变
B.容器内的混合气体的密度保持不变
C.水分子中断裂2NA个H-O键,同时氢分子中断裂3NA个H-H键
D.CH3OH和H2O的浓度之比保持不变
(3)反应II在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下:
物质 | CH3OCH3(g) | H2O(g) | CH3OH(g) |
浓度/mol·L-1 | 1.8 | 1.8 | 0.4 |
此时v正___v逆(填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH体积分数(CH3OH)% =___%。
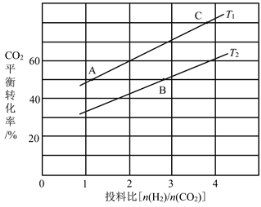
(4)在某压强下,反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6mol CO2和12mol H2充入2 L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=____;KA、KB、KC三者之间的大小关系为____。
(5)恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应I和反应III,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。其中:CH3OH的选择性=![]() ×100%
×100%

在上述条件下合成甲醇的工业条件是____。
A.210℃ B.230℃ C.催化剂CZT D.催化剂CZ(Zr-1)T