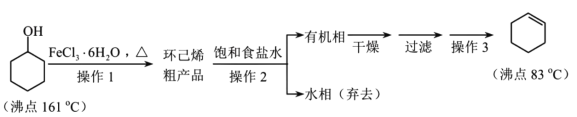
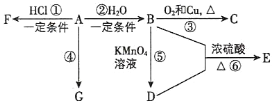
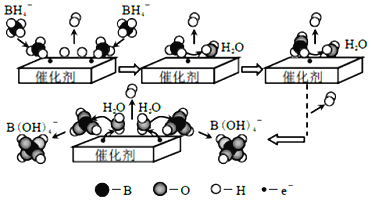
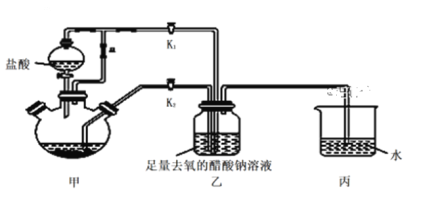
题目内容
【题目】已知有机物M在一定条件下可转化为N。下列说法正确的是( )

A.该反应类型为取代反应
B.可用溴水鉴别M和N
C.N分子中所有碳原子共平面
D.M的一氯代物共7种
【答案】B
【解析】
分析化学方程式,可知有机物M在一定条件下转化为N,是碳碳双键在一定条件下与H2发生了加成反应,根据与苯环和碳碳双键直接相连的原子共平面分析分子中原子共面问题。据此进行分析。
A.由化学反应方程式可知,该反应类型为加成反应,A项错误;
B.M分子中存在碳碳双键,能与溴水发生加成反应而使溴水褪色,N分子中不含能与溴水反应的基团,故不能使溴水褪色,可以用溴水鉴别M和N,B项正确;
C.N分子中与苯环直接相连的碳原子与苯环共面,N分子中异丙基是四面体结构,故N分子中不可能所有碳原子共平面,C项错误;
D.有机物分子中含有多少种等效氢,该有机物的一氯代物就有多少种,M分子中有5种等效氢,故M的一氯代物共5种,D项错误;
答案选B。

【题目】研究减少CO2排放是一项重要课题。CO2经催化加氢可以生成低碳有机物,主要有以下反应:
反应Ⅰ:CO2(g)+3H2(g) ![]() CH3OH(g)+H2O(g) △H1=-49.6 kJ/mol
CH3OH(g)+H2O(g) △H1=-49.6 kJ/mol
反应Ⅱ:CH3OCH3(g)+H2O(g) ![]() 2CH3OH(g) △H2=+23.4 kJ/mol
2CH3OH(g) △H2=+23.4 kJ/mol
反应Ⅲ:2CO2(g)+6H2(g) ![]() CH3OCH3(g)+3H2O(g) △H3
CH3OCH3(g)+3H2O(g) △H3
(1)△H3=________kJ/mol。
(2)恒温恒容条件下,在密闭容器中通入等物质的量的CO2和H2,发生反应I。下列描述能说明反应I达到平衡状态的是_______(填序号)。
A.反应体系总压强保持不变
B.容器内的混合气体的密度保持不变
C.水分子中断裂2NA个H-O键,同时氢分子中断裂3NA个H-H键
D.CH3OH和H2O的浓度之比保持不变
(3)反应II在某温度下的平衡常数为0.25,此温度下,在密闭容器中加入等物质的量的CH3OCH3(g)和H2O(g),反应到某时刻测得各组分浓度如下:
物质 | CH3OCH3(g) | H2O(g) | CH3OH(g) |
浓度/mol·L-1 | 1.8 | 1.8 | 0.4 |
此时v正___v逆(填“>”、“<”或“=”),当反应达到平衡状态时,混合气体中CH3OH体积分数(CH3OH)% =___%。
(4)在某压强下,反应III在不同温度、不同投料比时,CO2的平衡转化率如图所示。T1温度下,将6mol CO2和12mol H2充入2 L的密闭容器中,5min后反应达到平衡状态,则0~5min内的平均反应速率v(CH3OCH3)=____;KA、KB、KC三者之间的大小关系为____。

(5)恒压下将CO2和H2按体积比1:3混合,在不同催化剂作用下发生反应I和反应III,在相同的时间段内CH3OH的选择性和产率随温度的变化如图。其中:CH3OH的选择性=![]() ×100%
×100%
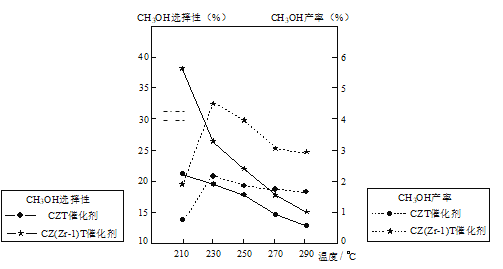
在上述条件下合成甲醇的工业条件是____。
A.210℃ B.230℃ C.催化剂CZT D.催化剂CZ(Zr-1)T