题目内容
12.用NA表示阿伏加德罗常数的值.下列叙述中不正确的是( )| A. | 0.1mol-NH2(氨基)中含有的电子数目为1.0NA | |
| B. | 常温下,1L 0.1mol•L-1 CH3COONa溶液中含有阴离子总数大于0.1NA | |
| C. | 标准状况下,2.24 LH2O中含有的原子总数大于0.3NA | |
| D. | 常温常压下,16 g O2和O3混合气体含有的氧原子数为NA |
分析 A、氨基不显电性;
B、根据溶液中电荷守恒来分析;
C、标况下,水为液态,密度约为1000g/L;
D、O2和O3均由氧原子构成.
解答 解:A、氨基不显电性,即1mol氨基含9mol电子,则0.1mol氨基中含0.9mol电子,故A错误;
B、在CH3COONa溶液中满足电荷守恒:n(CH3COO-)+n(OH-)=n(Na+)+n(H+)>CV=0.1mol/L×1L=0.1mol,即大于0.1NA个,故B正确;
C、标况下,水为液态,密度约为1000g/L,则2.24L水的质量为2240g,物质的量n=$\frac{2240g}{18g/mol}$=124.5mol,故含有的原子的物质的量为373.3mol,大于0.3mol,故C正确;
D、O2和O3均由氧原子构成,16g混合物中含有的氧原子的物质的量n=$\frac{16g}{16g/mol}$=1mol,即含有NA个,故D正确.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
20.阿伏加德罗常数为NA,下列说法正确的是( )
| A. | 1mol钠与氧气反应生成Na2O或Na2O2时,失电子数目均为NA | |
| B. | 将含有0.1molFeCl3的饱和溶液滴入沸水中,产生胶粒的数目为0.1NA | |
| C. | 1molC7H16中含有共价键的数目为23NA | |
| D. | 常温下,1L 0.1 mol•L-1的Na2CO3溶液中含有的离子总数为0.3NA |
17.某同学用下列装置(固定、加热仪器和橡胶管略)进行有关氨气制取的实验探究,回答下列问题.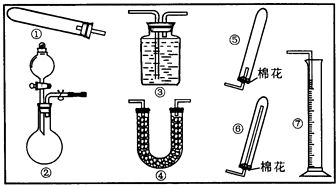
(1)若用装置①制取NH3,其反应的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;
若要测定生成的NH3的体积,则必须选择的装置是③⑦(填装置序号),装置中所盛试剂应具有的性质是氨气和该液体不能反应、氨气不能溶于该液体、该液体不能挥发.
(2)若用装置②制取并收集干燥的NH3,烧瓶内装的试剂是CaO或(NaOH或碱石灰),分液漏斗中装的试剂是浓氨水(或浓NH4Cl溶液),收集装置应选择⑥(填装置序号).
证明氨气已收集满的操作是用湿润的红色石蕊试纸靠近管口,若试纸变蓝则证明已收集满
检验装置②的气密性的方法是在橡胶管处接上导气管,关闭分液漏斗活塞,打开止水夹,将导气管末端插入水槽中,用热毛巾捂着烧瓶(或用酒精灯微热),导气管末端有气泡冒出,移开热毛巾(或停止加热)一段时间,导气管末端有一段水柱(或关闭装置②的止水夹和分液漏斗活塞,从分液漏斗的上端注入一定量的水,打开分液漏斗活塞,若漏斗中的水滴入烧瓶中的速率逐渐减慢至不再滴入,说明装置气密性良好)
(3)若用下列各种试剂组合(其它条件相同)进行制取氨气的对比实验,测出氨气的体积
(标准状况)如下表:
从表中数据分析,实验室制氨气的产率最高的⑥其原因是因为NH4Cl受热易分解,生成的部分NH3和HCl又重新结合生成NH4Cl;而用Ca(OH)2反应产生的水较多,吸收的NH3较多,所以用CaO和(NH4)2SO4反应产率最高.

(1)若用装置①制取NH3,其反应的化学方程式为2NH4Cl+Ca(OH)2$\frac{\underline{\;\;△\;\;}}{\;}$CaCl2+2H2O+2NH3↑;
若要测定生成的NH3的体积,则必须选择的装置是③⑦(填装置序号),装置中所盛试剂应具有的性质是氨气和该液体不能反应、氨气不能溶于该液体、该液体不能挥发.
(2)若用装置②制取并收集干燥的NH3,烧瓶内装的试剂是CaO或(NaOH或碱石灰),分液漏斗中装的试剂是浓氨水(或浓NH4Cl溶液),收集装置应选择⑥(填装置序号).
证明氨气已收集满的操作是用湿润的红色石蕊试纸靠近管口,若试纸变蓝则证明已收集满
检验装置②的气密性的方法是在橡胶管处接上导气管,关闭分液漏斗活塞,打开止水夹,将导气管末端插入水槽中,用热毛巾捂着烧瓶(或用酒精灯微热),导气管末端有气泡冒出,移开热毛巾(或停止加热)一段时间,导气管末端有一段水柱(或关闭装置②的止水夹和分液漏斗活塞,从分液漏斗的上端注入一定量的水,打开分液漏斗活塞,若漏斗中的水滴入烧瓶中的速率逐渐减慢至不再滴入,说明装置气密性良好)
(3)若用下列各种试剂组合(其它条件相同)进行制取氨气的对比实验,测出氨气的体积
(标准状况)如下表:
| 试剂组合/NH3体积(mL) | 6.0gCa(OH)2(s,过量) | 6.0NaOH(s,过量) | 6.0g CaO(s,过量) |
| 5.4g NH4Cl(s) | ①/1344 | ②/1568 | ③/1792 |
| 5.4(NH4)2SO4(s) | ④1364 | ⑤1559 | ⑥/1753 |
4.已知2H2(g)+O2(g)═2H2O(l)△H=-571.6kJ•mol-1,CO(g)+$\frac{1}{2}$O2(g)=CO2(g)△H=-283kJ•mol-1.某H2和CO的混合气体完全燃烧时放出113.74KJ热量,同时生成3.6g液态水,则气体中H2和CO的物质的量之比为( )
| A. | 2:1 | B. | 1:2 | C. | 1:1 | D. | 2:3 |
16.在两个密闭容器中,分别充有质量相同的甲乙两种气体,若它们的温度和密度均相同,试根据甲、乙的摩尔质量(M)关系,判断下列说法正确的是( )
| A. | 若M(甲)>M(乙),则气体体积:甲<乙 | |
| B. | 若M(甲)<M(乙),则气体压强:甲>乙 | |
| C. | 若M(甲)>M(乙),则气体的摩尔体积:甲>乙 | |
| D. | 若M(甲)<M(乙),则分子数:甲<乙 |
 病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签所提供的信息,回答下列问题:
病人输液用的葡萄糖注射液是葡萄糖(化学式为C6H12O6)的水溶液,其标签上的部分内容如图所示.利用标签所提供的信息,回答下列问题: