题目内容
【题目】实验室需要配制0.50 mol/LNaCl溶液480 mL。按下列操作步骤填上适当的文字,以使整个操作完整。
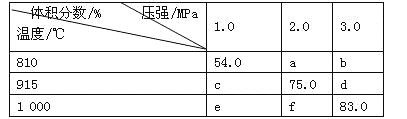
(1)选择仪器。完成本实验所必需的仪器有:托盘天平(精确到0.1 g)、药匙、烧杯、玻璃棒、________、________以及等质量的两片滤纸。
(2)计算称量。配制该溶液需称取NaCl晶体________g。
(3)溶解、冷却,该步实验中需要使用玻璃棒,目的是___________。
(4)转移、洗涤。
(5)向容量瓶中加入蒸馏水,直到液面离刻度线约1-2厘米时,改用___________滴加蒸馏水至液面与刻度线相切。盖好瓶塞,摇匀。如果加水时液面超过刻度线,将使配得的溶液浓度___________(填“偏高”、“偏低”或“无影响”)。
(6)将配好的溶液静置一段时间后,倒入指定的试剂瓶,并贴好标签,注明配制的时间、溶液名称及浓度。
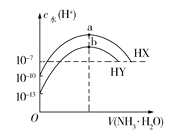
(7)在配制过程中,某学生观察定容时液面情况如图所示,所配溶液的浓度会________(填“偏高”、“偏低”或“无影响”)。

【答案】500mL容量瓶 胶头滴管 14.6 搅拌,加速溶解速率 胶头滴管 偏低 偏低
【解析】
(1)实验室没有480mL容量瓶,所以需要配制500mL溶液,根据配制500mL 0.50mol/LNaCl溶液的步骤选用仪器;
(2)根据n=cV、m=nM计算出NaCl晶体的质量;
(3)溶解氯化钠时需要使用玻璃棒搅拌,加速氯化钠的溶解过程;
(5)定容时需要用胶头滴管,根据c=![]() 分析误差;
分析误差;
(7)图为仰视定容,据此分析。
(1)操作步骤有计算、称量、溶解、冷却、移液、洗涤移液、定容、摇匀等操作,一般用托盘天平称量,用药匙取用药品,在烧杯中溶解(可用量筒量取水加入烧杯),并用玻璃棒搅拌,加速溶解,冷却后转移到500mL容量瓶中,并用玻璃棒引流,洗涤烧杯、玻璃棒2~3次,并将洗涤液移入容量瓶中,加水至液面距离刻度线1~2cm时,改用胶头滴管滴加,最后定容颠倒摇匀,所用仪器有托盘天平、烧杯、玻璃棒、500mL容量瓶、胶头滴管、药匙,尚缺的仪器或用品有:500mL容量瓶、胶头滴管;
(2)需要氯化钠的质量为:m=nM=cVM=0.5L×0.5molL1×58.5g/mol=14.625g,因此需要称取NaCl晶体的质量是14.6g;
(3)溶解的实验中需要使用玻璃棒进行搅拌,加速氯化钠的溶解;
(5)向容量瓶中加入蒸馏水,直到液面离刻度线约1-2厘米时,定容时,用胶头滴管滴加液体至与凹液面最低点相切,一旦液体加多,c=![]() ,V偏大,浓度偏低;
,V偏大,浓度偏低;
(7)在配制过程中,某学生观察定容时液面情况如图所示,为仰视,会导致加入的蒸馏水体积V增加,根据c=![]() 可知浓度会偏低。
可知浓度会偏低。

 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案【题目】在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度T的关系如下表:
T/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应为____________反应(填“吸热”、“放热”)。
(2)能使该反应的反应速率增大,且平衡向正反应方向移动的是___________。
a.及时分离出CO气体 b.适当升高温度
c.增大CO2的浓度 d.选择高效催化剂
(3)某温度,平衡浓度符合下式: c(CO2)·c(H2)=c(CO)·c(H2O),试判断此时的温度为______℃。
(4)若在(3)所处的温度下,在1L的密闭容器中,加入2molCO2和3molH2充分反应达平衡时,H2的物质的量为__________,CO2的物质的量为__________。
a.等于1.0mol b.大于1.0mol c.大于0.5mol,小于1.0mol d.无法确定
(5)根据研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3的TiO2)表面与水发生下列反应:2N2(g)+6H2O(l)![]() 4NH3(g)+3O2(g) ΔH=akJ·mol-1
4NH3(g)+3O2(g) ΔH=akJ·mol-1
进一步研究NH3生成量与温度的关系,常压下达到平衡时测得部分实验数据如表:
T/K | 303 | 313 | 323 |
NH3生成量/(10-6 mol) | 4.8 | 5.9 | 6.0 |
①此合成反应的
②已知:N2(g)+3H2(g)=2NH3(g) ΔH=-92.4kJ·mol-1
2H2(g)+O2(g)=2H2O(l) ΔH=-571.6kJ·mol-1
则常温下氮气与水反应生成氨气与氧气的热化学方程式为:_____________________________。