题目内容
【题目】将E和F加入密闭容器中,在一定条件下发生反应:E(g)+F(s)![]() 2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。下列说法错误的是
2G(g)。忽略固体体积,平衡时G的体积分数(%)随温度和压强的变化如下表所示。下列说法错误的是
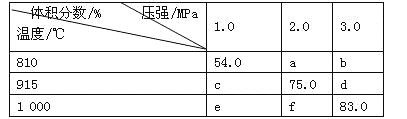
A.a<54.0
B.b> f
C.915 ℃,2.0 MPa时E的转化率为60%
D.K(1000 ℃)>K(810 ℃)
【答案】B
【解析】
A.由于该反应的正反应是气体体积增大的反应,在其它条件不变时,增大压强,平衡向气体体积减小的方向移动,所以达到平衡时,G的体积分数减小,因此a<54.0,A正确;
B.由于压强b>a,所以平衡时G的体积分数b<a,温度810℃<915℃,在压强不变时,升高温度G的体积分数增大,说明该反应的正反应是吸热反应,由于温度f是1000℃>915℃,所以平衡时G的体积分数f大于75.0,因此b<f,B错误;
C.915 ℃,2.0 MPa时G的体积分数是75.0%,则未反应的E是25.0%,假设反应开始时E的物质的量是amol,反应消耗E是x,则反应产生的F是2x,所以(a-x)/2x=25.0%÷75.0%,解得x=0.6a,所以E的转化率为60%,C正确;
D.根据B分析可知该反应的正反应是吸热反应,升高温度,平衡向吸热的正反应方向移动,所以K(1000 ℃)>K(810 ℃),D正确;
答案选B。

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目