题目内容
【题目】在2L密闭容器内,800℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=__________。
(2)0~2 s内该反应的平均速率v(NO)=__________, v(O2)=__________。
(3)能说明该反应已达到平衡状态的是__________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a.及时分离出NO2气体 b.增大O2的浓度
c.扩大容器体积 d.选择高效催化剂
【答案】 K=![]() 3.0×10-3 mol/(L·s) 1.5×10-3 mol/(L·s) bc b
3.0×10-3 mol/(L·s) 1.5×10-3 mol/(L·s) bc b
【解析】(1)平衡常数表达式等于生成物的浓度幂之积比上反应物的浓度幂之积,K=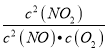 ;故答案为:K=
;故答案为:K=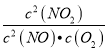 ;
;
(2)2s内用NO表示的平均反应速率v(NO)= ![]() =
=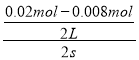 =3.0×10-3molL-1s-1,速率之比等于化学计量数之比,所以v(O2)=
=3.0×10-3molL-1s-1,速率之比等于化学计量数之比,所以v(O2)= ![]() v(NO)=
v(NO)= ![]() ×3.0×10-3molL-1s-1=1.5×10-3molL-1s-1,故答案为:3.0×10-3molL-1s-1;1.5×10-3molL-1s-1;
×3.0×10-3molL-1s-1=1.5×10-3molL-1s-1,故答案为:3.0×10-3molL-1s-1;1.5×10-3molL-1s-1;
(3)a.任何时候都存在v(NO2)=2v(O2),无法判断正逆反应速率是否相等,故a错误; b.反应前后气体体积不同,压强不变说明正逆反应速率相等,各组分浓度不变,故b正确;c.v逆(NO)=2v正(O2)时,说明一氧化氮正逆反应速率相等,反应达到平衡状态,故c正确; d.恒容容器,反应物生成物都是气体,质量不变,密度始终不变,所以密度不变不一定是平衡状态,故d错误;故选:bc;
(4)2NO(g)+O2(g)═2NO2(g)△H<0,反应是气体体积减小的放热反应。a.及时分离除NO2气体,减少生成物浓度,平衡正向进行,但反应速率减小,故a错误;b.增大O2的浓度,化学反应速率加快,平衡正向移动,故b正确;c.扩大容器体积,气体的压强减小,反应速率减慢,故c错误;d.选择高效催化剂,化学反应速率加快,平衡不移动,故d错误,故答案为:b。
点晴:注意只有反应前后不相同的量才能作为判断化学平衡的依据。反应到达平衡状态时,正逆反应速率相等,平衡时各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化。反应前后不改变的量不能作为判断化学平衡的依据,如该反应中的气体的密度就不能作为判断化学平衡的依据。