题目内容
【题目】如图为反应2H2(g)+O2(g)═2H2O(g)的能量变化示意图.下列说法正确的是( )
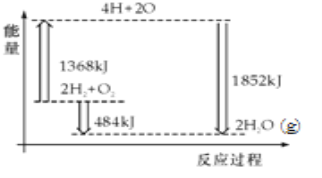
A. H2(g)和O2(g)反应生成H2O(g ),这是吸热反应
B. 2mol H2和1mol O2转化为4mol H、2mol O原子的过程中放出热量
C. 2mol H2(g)和1mol O2(g)反应生成2mol H2O(g),共放出484kJ能量
D. 4mol H、2mol O生成2mol H2O(g),共放出484kJ能量
【答案】C
【解析】由图可知,反应物的总能量高于生成物的总能量,所以该反应是放热反应。反应物分子断裂化学键成为原子吸收了1368kJ的能量,再变成生成物分子后又释放了1852kJ的能量 。A. H2(g)和O2(g)反应生成H2O(g ),是放热反应,A不正确;B. 2mol H2和1mol O2转化为4mol H、2mol O原子的过程中要破坏化学键,所以要吸收热量,B不正确;C.由图中信息可知, 2mol H2(g)和1mol O2(g)反应生成2mol H2O(g),共放出484kJ能量,C正确;D. 由图中信息可知,4mol H、2mol O生成2mol H2O(g),共放出1852kJ能量,D不正确。本题选C。

 阅读快车系列答案
阅读快车系列答案【题目】在2L密闭容器内,800℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=__________。
(2)0~2 s内该反应的平均速率v(NO)=__________, v(O2)=__________。
(3)能说明该反应已达到平衡状态的是__________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a.及时分离出NO2气体 b.增大O2的浓度
c.扩大容器体积 d.选择高效催化剂
【题目】已知Fe2O3(s)+3CO(g)2Fe(s)+3CO2(g)在不同温度下的平衡常数如表:
温度/℃ | 1000 | 1150 | 1300 |
平衡常数 | 42.9 | 50.7 | 64.0 |
请回答下列问题:
(1)该反应的平衡常数表达式K= ______ ,△H ______ 0(填“>”、“<”或“=”)。
(2)在一个容积为10L的密闭容器中,1300℃时加入Fe、Fe2O3、CO、CO2各1mol,反应经过10min后达到平衡.求该时间范围内反应的平均反应速率v(CO2)= ______ ,CO的平衡转化率为 ______。
(3)欲提高(2)中CO的平衡转化率,可采取的措施是 ______。
A.增加Fe2O3的量B.加入合适的催化剂C.移出部分CO2D.提高反应温度.

