题目内容
【题目】氯化亚硝酰(NOCl)具有强氧化性,易与水反应生成HCl和氮氧化物。实验室可通过反应Cl2+2NO![]() 2NOCl △H<0制备
2NOCl △H<0制备
回答下列问题:
(1)甲组同学拟用下图所示装置(夹持仪器未画出)拟制备Cl2和NO。

①制取Cl2时,分液漏斗中加入浓盐酸,则烧瓶中放入的固体药品可能是______。
②制取NO时,铜与稀硝酸反应的离子方程式为_________。
(2)乙组的同学制氯化亚硝酰(沸点为-5.5℃)的装置如下:
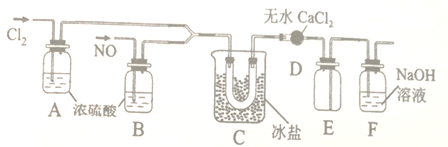
①装置D的作用是___________;装置E的作用是________。
②装置C中冰盐冷却的目的是___________(写两点)。
(3)丙组依据文献记载,氯化亚硝酰也可用NaNO2固体与气体制备,该反应的化学方程式为___。
【答案】 KMnO4 3Cu+8H++2NO3-=3Cu2++2NO↑ +4H2O 防止水蒸气进入反应器 防止倒吸 降低温度有利于反应向生成氯化亚硝酸方向进行,并冷凝收集产物 NaNO2+2HCl=NOCl+NaCl+H2O
【解析】试题分析:由题意知,氯化亚硝酰(NOCl)具有强氧化性,氯化亚硝酰沸点为-5.5℃,在常温下是气体,易与水反应生成HCl和氮氧化物。实验室可通过反应Cl2+2NO![]() 2NOCl 来制备氯化亚硝酰,该反应为放热反应。
2NOCl 来制备氯化亚硝酰,该反应为放热反应。
(1)①制取Cl2时,分液漏斗中加入浓盐酸,由于没有加热仪器,所以烧瓶中放入的固体药品可能是KMnO4 等强氧化剂。
②制取NO时,铜与稀硝酸反应的离子方程式为3Cu+8H++2NO3-=3Cu2++2NO↑ +4H2O。
(2)①装置D的作用是防止F中水蒸气进入反应器C;装置E的作用是防止倒吸。
②装置C中冰盐冷却的目的是降低温度有利于反应向生成氯化亚硝酸方向进行,并冷凝收集产物。
(3)氯化亚硝酰可用NaNO2固体与气体制备,则该气体一定是HCl,反应的化学方程式为NaNO2+2HCl=NOCl+NaCl+H2O 。

【题目】在2L密闭容器内,800℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=__________。
(2)0~2 s内该反应的平均速率v(NO)=__________, v(O2)=__________。
(3)能说明该反应已达到平衡状态的是__________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a.及时分离出NO2气体 b.增大O2的浓度
c.扩大容器体积 d.选择高效催化剂