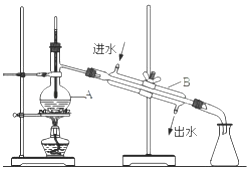
题目内容
【题目】在加热的条件下,用MnO2与100mL物质的量浓度为12mol/L的浓盐酸反应,制得氯气2.24L(标准状况).(已知MnO2+4HCl(浓) ![]() MnCl2+Cl2↑+2H2O)
MnCl2+Cl2↑+2H2O)
(1)需要消耗MnO2多少克?
(2)被氧化的HCl的物质的量是多少?
(3)若反应后溶液的体积不变,则反应后溶液中Cl﹣物质的量浓度是多少?
【答案】
(1)解: ![]() ,
,
MnO2+4HCl(浓) | Cl2↑+2H2O |
1 | 1 |
0.1mol | 0.1mol |
则m(MnO2)=0.1mol×87g.mol﹣1=8.7g,
答:需要消耗MnO28.7g;
(2)解:因Cl元素的化合价升高时被氧化,氧化产物为氯气,
则被氧化的HCl的物质的量n=2n(Cl2)=2×0.1mol=0.2mol,
答:被氧化的HCl的物质的量是0.2mol;
(3)解:反应后溶液中的Cl﹣减少了2×n(Cl2)=0.2mol,
反应后溶液中n(Cl﹣)=12molL﹣1×0.1L﹣0.2mol=1mol,
则 ![]() ,
,
答:反应后溶液中Cl﹣物质的量浓度是10mol/L.
【解析】(1)根据氯气的体积计算其物质的量,代入化学反应方程式来计算二氧化锰的物质的量,再利用m=n×M来计算;(2)根据氯原子守恒及化合价变化可知,氯气中氯原子的物质的量即为被氧化的HCl的物质的量;(3)减少的氯离子的物质的量等于氯气中氯原子的物质的量,利用离子守恒来分析计算.

 智慧小复习系列答案
智慧小复习系列答案【题目】在2L密闭容器内,800℃时反应2NO(g)+O2(g) ![]() 2NO2(g)体系中,n(NO)随时间的变化如下表:
2NO2(g)体系中,n(NO)随时间的变化如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)写出该反应的平衡常数表达式:K=__________。
(2)0~2 s内该反应的平均速率v(NO)=__________, v(O2)=__________。
(3)能说明该反应已达到平衡状态的是__________。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
(4)能使该反应的反应速率增大,且平衡向正反应方向移动的是__________。
a.及时分离出NO2气体 b.增大O2的浓度
c.扩大容器体积 d.选择高效催化剂