题目内容
9.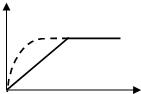 如图曲线a表示放热反应 X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
如图曲线a表示放热反应 X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )| A. | 加催化剂 | B. | 增大体积 | C. | 升高温度 | D. | 加大X的投入量 |
分析 图中给出的是X转化率随着反应时间的变化关系,从图中a、b两条曲线可以看出二者达到平衡时的X的转化率相同,说明改变条件后平衡不发生移动,但是达到平衡用的时间不同,b曲线先达到平衡,说明改变条件后反应速率快;
分析影响化学反应速率的因素和影响化学平衡移动的因素,要想加快反应速率但是平衡不移动,可能的条件是:一使用催化剂;二加压(只对反应前后气体体积不变的反应).
解答 解:A.加催化剂,反应速率加快,平衡不移动,故A正确;
B.该反应前后气体体积不变,增大体积,反应速率减慢,平衡不移动,故B错误;
C.升高温度,反应速率加快,平衡逆向移动,故C错误;
D.加大X的投入,反应速率加快,平衡正向移动,故D错误;
故选A.
点评 本题结合图象考查影响化学速率和化学平衡移动的因素,难度中等,要注意基础知识的积累.

练习册系列答案
相关题目
20.100mL 2mol/L的盐酸跟过量的锌片反应,一定温度下为减慢反应速率而又不影响生成氢气的总量,可采用的方法是( )
| A. | 加入适量NaNO3溶液 | B. | 加入适量NaOH溶液 | ||
| C. | 加入适量Na2CO3溶液 | D. | 加入适量NaCl溶液 |
17.下列物质中,一氯代物的同分异构体有2种的是( )
| A. | 乙烷 | B. | 丙烷 | C. | 正戊烷 | D. | 新戊烷 |
14.关于下列变化的比较,正确的是( )
| A. | 氢化物稳定性:HI>HBr>HCl>HF | |
| B. | 酸性强弱:HNO3>H3PO4>H2SO4 | |
| C. | 离子半径由大到小:O2->F->Na+>Mg2+ | |
| D. | 碱性强弱:RbOH<KOH<NaOH<LiOH |
13.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
回答下列问题:
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)c(H{\;}_{2}O)}{c(CO{\;}_{2})c(H{\;}_{2})}$.
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)某温度下,各物质的平衡浓度符合下式:3c(CO2)•c(H2)=5c(CO)•c(H2O),试判断此时的温度为700℃.
(4)若830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数K等于1.0(选填“大于”、“小于”或“等于”).
(5)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,扩大容器的体积.试用平衡常数判断平衡不发生移动(填“发生”或“不发生”).
| t℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)c(H{\;}_{2}O)}{c(CO{\;}_{2})c(H{\;}_{2})}$.
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)某温度下,各物质的平衡浓度符合下式:3c(CO2)•c(H2)=5c(CO)•c(H2O),试判断此时的温度为700℃.
(4)若830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数K等于1.0(选填“大于”、“小于”或“等于”).
(5)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,扩大容器的体积.试用平衡常数判断平衡不发生移动(填“发生”或“不发生”).
 ;B的原子在周期表中的位置是第三周期ⅡA族
;B的原子在周期表中的位置是第三周期ⅡA族