题目内容
13.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)?CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:| t℃ | 700 | 800 | 830 | 1 000 | 1 200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
(1)该反应的化学平衡常数表达式为K=$\frac{c(CO)c(H{\;}_{2}O)}{c(CO{\;}_{2})c(H{\;}_{2})}$.
(2)该反应为吸热反应(填“吸热”或“放热”).
(3)某温度下,各物质的平衡浓度符合下式:3c(CO2)•c(H2)=5c(CO)•c(H2O),试判断此时的温度为700℃.
(4)若830℃时,向容器中充入1mol CO、5mol H2O,反应达到平衡后,其化学平衡常数K等于1.0(选填“大于”、“小于”或“等于”).
(5)830℃时,容器中的反应已达到平衡.在其他条件不变的情况下,扩大容器的体积.试用平衡常数判断平衡不发生移动(填“发生”或“不发生”).
分析 (1)依据化学方程式和平衡常数概念书写平衡常数;
(2)平衡常数随温度升温增大,说明平衡正向进行,结合平衡移动原理分析判断;
(3)依据平衡常数计算式和图表数据分析判断;
(4)依据平衡常数仅与温度有关判断;
(5)根据该反应为气体体积不变的反应,扩大容器的体积反应物,则反应物和生成物浓度同时减小,所以根据K=$\frac{c(CO)c(H{\;}_{2}O)}{c(CO{\;}_{2})c(H{\;}_{2})}$,即K不变,则平衡不移动.
解答 解:(1)CO2(g)+H2(g)?CO(g)+H2O(g),反应的平衡常数K=$\frac{c(CO)c(H{\;}_{2}O)}{c(CO{\;}_{2})c(H{\;}_{2})}$,故答案为:$\frac{c(CO)c(H{\;}_{2}O)}{c(CO{\;}_{2})c(H{\;}_{2})}$;
(2)图表中平衡常数随温度升高增大,说明升温平衡正向进行,正反应是吸热反应,故答案为:吸热;
(3)某温度下,平衡浓度符合下式:3c(CO2)•c(H2)=5c(CO)•c(H2O),所以K=0.6,依据图表数据可知,平衡常数随温度变化,温度不变,平衡常数不变,判断此时的温度为700℃;
故答案为:700℃;
(4)平衡常数仅与温度有关,所以830℃其化学平衡常数K一直等于1,故答案为:等于;
(5)根据该反应为气体体积不变的反应,扩大容器的体积反应物,则反应物和生成物浓度同时减小,所以根据K=$\frac{c(CO)c(H{\;}_{2}O)}{c(CO{\;}_{2})c(H{\;}_{2})}$,即K不变,则平衡不移动,故答案为:不发生.
点评 本题考查学生可逆反应的特征以及化学平衡移动方面的知识,平衡常数计算,平衡标志分析是关键,注意知识的积累是解题的关键,难度不大.

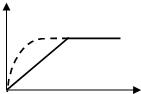 如图曲线a表示放热反应 X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
如图曲线a表示放热反应 X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )| A. | 加催化剂 | B. | 增大体积 | C. | 升高温度 | D. | 加大X的投入量 |
| A. | 氢气分子内每个氢原子都达到8电稳定结构 | |
| B. | 氢气分子的能量比氢原子的能量低 | |
| C. | 1molH2离解成2molH 要放出437.6kJ 热量 | |
| D. | 氢原子的还原性比氢分子的还原性弱 |
| A. | 每摩尔Si晶体中,含有2摩尔Si-Si共价键 | |
| B. | 在CO2晶体中,与每个CO2分子周围紧邻的有12个CO2分子 | |
| C. | 在CsCl晶体中,与每个Cs+周围紧邻的有8个Cl-,而与每个Cs+等距离紧邻的也有8个Cs+ | |
| D. | 在金刚石晶体中,最小碳原子环含有6个碳原子 |
| A. | ①可能形成AgBr沉淀 | B. | ①一定能有效分离Cl-与Br- | ||
| C. | ②一定不能形成AgCl沉淀 | D. | ②一定能有效分离Cl-与Br- |
| A. | Fe>Fe3+>Fe2+ | B. | Cl>S>P | C. | O2->Na+>Al3+ | D. | Ar>Kr>Xe |


 在一定温度下,4L密闭容器内存在反应2N?M,其中气体M、气体N的物质的量随时间变化的曲线如图所示:
在一定温度下,4L密闭容器内存在反应2N?M,其中气体M、气体N的物质的量随时间变化的曲线如图所示: