题目内容
1.结合电解质在水溶液中的变化及反应,判断下列说法正确的是( )①漂白粉的水溶液中可存在:Fe2+、Cl-、SiO32-、Na+
②滴加石蕊试液呈红色的溶液:K+、Na+、ClO4-、F-
③能够与金属Cu常温下反应放出气体的溶液:Fe3+、Al3+、SO42-、K+
④常温下pH=7的溶液中:NH4+、Na+、Cl-、Fe3+
⑤FeCl3溶液中通入SO2,溶液由黄色变成浅绿色:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
⑥Al2(SO4)3溶液滴加氨水产生白色胶状沉淀:Al3++3OH-=Al(OH)3↓
⑦Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I-=2Fe2++I2.
| A. | ②③⑥ | B. | ③⑤ | C. | ②③④ | D. | ④⑤ |
分析 ①漂白粉的水溶液中存在钙离子和次氯酸根离子,钙离子与硅酸根离子反应,次氯酸根离子能够氧化亚铁离子;
②滴加石蕊试液呈红色的溶液为酸性溶液,氟离子与酸性溶液中的氢离子结合生成氟化氢;
③能够与金属Cu常温下反应放出气体的溶液具有强氧化性,四种离子之间不反应,都不与强氧化性的物质反应;
④铵根离子和铁离子能够发生水解,溶液显示酸性,不可能为中性溶液;
⑤FeCl3溶液中通入SO2,二者发生氧化还原反应生成亚铁离子;
⑥一水合氨为弱电解质,离子方程式中一水合氨不能拆开;
⑦碘化氢过量,铁离子和硝酸根离子都完全反应,漏掉了硝酸根离子与碘离子的反应.
解答 ①漂白粉的主要成分为氯化钙、次氯酸钙,其水溶液中存在Ca2+、ClO-,Ca2+与SiO32-离子反应、ClO-离子能够Fe2+,在溶液中不能大量共存,故①错误;
②滴加石蕊试液呈红色的溶液为酸性溶液,溶液中存在大量氢离子,F-与氢离子结合生成HF,在溶液中不能大量共存,故②错误;
③能够与金属Cu常温下反应放出气体的溶液应该具有强氧化性,Fe3+、Al3+、SO42-、K+离子之间不发生反应,且都不与强氧化性的物质反应,在溶液中能够大量共存,故③正确;
④常温下pH=7的溶液为中性溶液,而NH+4、Fe3+在溶液中水解,溶液显示酸性,不可能为中性溶液,故④错误;
⑤FeCl3溶液中通入SO2,铁离子被还原成亚铁离子,则溶液由黄色变成浅绿色,反应的离子方程式为:2Fe3++SO2+2H2O=2Fe2++SO42-+4H+,故⑤正确;
⑥Al2(SO4)3与氨水反应生成氢氧化铝沉淀和硫酸铵,一水合氨不能拆开,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故⑥错误;
⑦硝酸铁溶液中滴加足量HI溶液,铁离子和硝酸根离子都参与反应,正确的离子方程式为:Fe3++3NO3-+12H++10I-=Fe2++5I2+3NO↑+6H2O,故⑦错误;
根据分析可知,正确的为:③⑤,
故选B.
点评 本题考查了离子共存、离子方程式的书写判断,题目难度中等,试题知识点较多、题量较大,充分考查学生灵活应用基础知识的能力,注意熟练掌握离子共存的条件、离子方程式的书写原则.

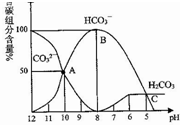 常温下,某Na2CO3溶液中含有碳组分含量(物质的量分数)随溶液的pH逐渐降低而发生变化如图,下列说法正确的是( )
常温下,某Na2CO3溶液中含有碳组分含量(物质的量分数)随溶液的pH逐渐降低而发生变化如图,下列说法正确的是( )| A. | 在滴有酚酞的Na2CO3溶液中逐滴加盐酸至溶液恰好变为无色,得到溶液 | |
| B. | 有CO2气体放出的范围是pH≤5 | |
| C. | HCO3-的电离平衡常数为1×10-4 | |
| D. | pH=11的Na2CO3溶液稀释到体积为原来的100倍后pH=9 |
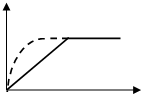 如图曲线a表示放热反应 X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
如图曲线a表示放热反应 X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )| A. | 加催化剂 | B. | 增大体积 | C. | 升高温度 | D. | 加大X的投入量 |
| A. | 聚丙烯的结构简式为: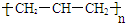 | B. | 苯分子的比例模型: | ||
| C. | 四氯化碳分子的电子式为: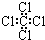 | D. | 乙烯的结构简式:CH2CH2 |
| 反应时间/min | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
| 烧杯和药品的总质量/g | 210.0 | 206.8 | 205.9 | 205.7 | 205.6 | 205.6 | 205.6 |
(1)反应结束时,收集到CO2的体积(标准状况下);
(2)该样品中NaHCO3的质量分数.
| A. | 若两元素原子序数相差8,则周期数一定相差1 | |
| B. | 两种简单离子不可能相差3个电子层 | |
| C. | 同族的两元素之间不可能形成化合物 | |
| D. | 最外层电子数相同的微粒一定位于同一族 |
| A. | 氢气分子内每个氢原子都达到8电稳定结构 | |
| B. | 氢气分子的能量比氢原子的能量低 | |
| C. | 1molH2离解成2molH 要放出437.6kJ 热量 | |
| D. | 氢原子的还原性比氢分子的还原性弱 |
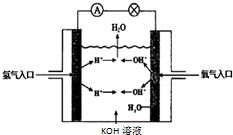 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答下列问题:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答下列问题: