题目内容
20.100mL 2mol/L的盐酸跟过量的锌片反应,一定温度下为减慢反应速率而又不影响生成氢气的总量,可采用的方法是( )| A. | 加入适量NaNO3溶液 | B. | 加入适量NaOH溶液 | ||
| C. | 加入适量Na2CO3溶液 | D. | 加入适量NaCl溶液 |
分析 Zn过量,生成氢气由盐酸定,为了减慢反应速率,且不影响生成氢气的总量,可减小氢离子的浓度,但不能改变盐酸的物质的量,以此来解答.
解答 解:A.加入适量NaNO3溶液,不能生成氢气,生成气体为NO,故A错误;
B.加入适量NaOH溶液,消耗盐酸,生成氢气的总量减小,故B错误;
C.加入适量Na2CO3溶液,消耗盐酸,生成氢气的总量减小,故C错误;
D.加入适量NaCl溶液,溶液体积增大,反应速率减小,由于盐酸物质的量不变,则生成氢气的总量不变,故D正确;
故选D.
点评 本题考查影响反应速率的因素,为高考常考考点,注意Zn过量,生成氢气的量由盐酸定,把握浓度对反应速率的影响即可解答,题目难度不大.

练习册系列答案
 暑假作业海燕出版社系列答案
暑假作业海燕出版社系列答案
相关题目
11.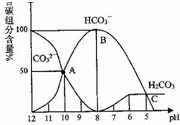 常温下,某Na2CO3溶液中含有碳组分含量(物质的量分数)随溶液的pH逐渐降低而发生变化如图,下列说法正确的是( )
常温下,某Na2CO3溶液中含有碳组分含量(物质的量分数)随溶液的pH逐渐降低而发生变化如图,下列说法正确的是( )
 常温下,某Na2CO3溶液中含有碳组分含量(物质的量分数)随溶液的pH逐渐降低而发生变化如图,下列说法正确的是( )
常温下,某Na2CO3溶液中含有碳组分含量(物质的量分数)随溶液的pH逐渐降低而发生变化如图,下列说法正确的是( )| A. | 在滴有酚酞的Na2CO3溶液中逐滴加盐酸至溶液恰好变为无色,得到溶液 | |
| B. | 有CO2气体放出的范围是pH≤5 | |
| C. | HCO3-的电离平衡常数为1×10-4 | |
| D. | pH=11的Na2CO3溶液稀释到体积为原来的100倍后pH=9 |
8.下列分子中键角最小的是( )
| A. | CH4 | B. | NH3 | C. | H2O | D. | CO2 |
5.如图是实验室常见的气体制取、干燥和收集装置.若用过氧化氢和二氧化锰来制取干燥的氧气,则合理的装置组合为( )


| A. | ①⑤⑥ | B. | ②④⑥ | C. | ②⑤⑦ | D. | ③④⑦ |
9.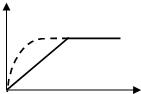 如图曲线a表示放热反应 X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
如图曲线a表示放热反应 X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
 如图曲线a表示放热反应 X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )
如图曲线a表示放热反应 X(g)+Y(g)?Z(g)+M(g)+N(s)进行过程中X的转化率随时间变化的关系.若要改变起始条件,使反应过程按b曲线进行,可采取的措施是( )| A. | 加催化剂 | B. | 增大体积 | C. | 升高温度 | D. | 加大X的投入量 |
4.已知2H→H2并放出437.6kJ的热量,下列说法正确的是( )
| A. | 氢气分子内每个氢原子都达到8电稳定结构 | |
| B. | 氢气分子的能量比氢原子的能量低 | |
| C. | 1molH2离解成2molH 要放出437.6kJ 热量 | |
| D. | 氢原子的还原性比氢分子的还原性弱 |
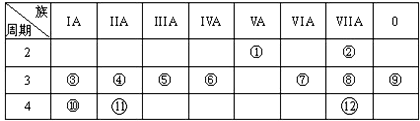
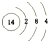 ,写出①的气态氢化物分子的电子式
,写出①的气态氢化物分子的电子式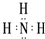 .
. .
.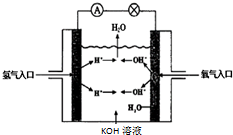 氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答下列问题:
氢氧燃料电池是符合绿色化学理念的新型发电装置.如图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定.请回答下列问题: