题目内容
6.下列说法正确的是( )| A. | HF、HCl、HBr、HI 的热稳定性依次减弱 | |
| B. | HF、HCl、HBr、HI 的熔沸点逐渐升高 | |
| C. | 第ⅠA族元素和第ⅦA元素形成的化合物都属于离子化合物 | |
| D. | 因为H2O分子间存在氢键,所以热稳定性:H2O>H2S |
分析 A.非金属性越强,对应的氢化物越稳定;
B.氢化物的相对分子质量越大,沸点越高,含有氢键的沸点较高;
C.第IA的H元素与第ⅦA元素形成共价化合物;
D.氢键与物质的物理性质有关.
解答 解:A.非金属性越强,对应的氢化物越稳定,非金属性:F>Cl>Br>I,则HF、HCl、HBr、HI 的热稳定性依次减弱,故A正确;
B.氢化物的相对分子质量越大,沸点越高,含有氢键的沸点较高,HF分子间存在氢键,沸点较高,则HCl、HBr、HI、HF 的熔沸点逐渐升高,故B错误;
C.第ⅠA族元素存在非金属性元素H,H元素与第ⅦA元素形成共价化合物,故C错误;
D.氢键与物质的物理性质有关,氢化物的稳定性与共价键强弱有关,H2O中H-O键能大于H2S中H-S的键能,所以热稳定性:H2O>H2S,故D错误.
故选A.
点评 本题考查了物质性质的比较,涉及非金属性、氢化物的稳定性、氢键等,题目难度不大.

练习册系列答案
相关题目
16.下列物质不可以导电的是( )
| A. | 甲苯 | B. | 金属Cu | C. | NaCl溶液 | D. | HCl溶液 |
17.NA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 标准状况下,11.2 L的己烷所含的分子数为0.5 NA 个 | |
| B. | 28 g乙烯所含共用电子对数目为6 NA个 | |
| C. | 标准状况下,11.2 L二氯甲烷所含分子数为0.5 NA个 | |
| D. | 现有乙烯、丙烯、丁烯的混合气体共14 g,其原子数为6 NA个 |
14.意大利一所大学的科学家制造出了由4个氧原子构成的一种新型分子.下列说法正确的是( )
| A. | 该分子是氧元素的一种同位素 | B. | 该分子的摩尔质量为64 g | ||
| C. | 该物质与氧气互为同素异形体 | D. | 该物质是一种氧化物 |
1.下列反应既是吸热反应,又属于氧化还原反应的是( )
| A. | 铝片与稀盐酸的反应 | B. | Ba(OH)2.8H2O与NH4Cl的反应 | ||
| C. | 灼热的炭与CO2的反应 | D. | 稀盐酸与稀氢氧化钠溶液的反应 |
18.下列有机分子中,所有原子不可能处于同一平面内的是( )
| A. | CH2=CH2 | B. | CH2=CH-CH=CH2 | C. | 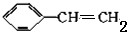 | D. | 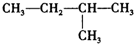 |
15.把含硫40%的硫铁矿先制成硫酸,再吸收氨气制成硫酸铵.1t这种硫铁矿在理论上能制得硫酸铵( )
| A. | 2.26 t | B. | 1.98 t | C. | 1.65 t | D. | 1.06 t |
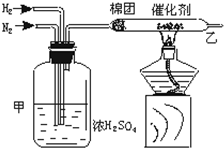 实验室中可用如图所示的装置合成NH3.
实验室中可用如图所示的装置合成NH3.