题目内容
1.钒是一种重要的合金元素,还用于催化剂和新型电池.从含钒固体废弃物(含有SiO2、Al2O3及其他残渣)中提取钒的一种新工艺主要流程如图1: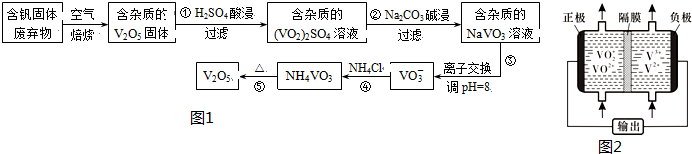
部分含钒化合物在水中的溶解性如表:
| 物质 | V2O5 | NH4VO3 | VOSO4 | (VO2)2SO4 |
| 溶解性 | 难溶 | 难溶 | 可溶 | 易溶 |
(1)反应①所得溶液中除H+之外的阳离子有VO2+和Al3+
(2)反应②碱浸后滤出的固体主要成分是Al(OH)3(写化学式).
(3)反应④的离子方程式为VO3-+NH4+=NH4VO3↓.
(4)25℃、101 kPa时,4Al(s)+3O2(g)═2Al2O3(s)△H1=-a kJ/mol
4V(s)+5O2(g)═2V2O5(s)△H2=-b kJ/mol
用V2O5发生铝热反应冶炼金属钒的热化学方程式是10Al(s)+3V2O5(s)=5Al2O3(s)+6V(s)△H=-$\frac{5a-3b}{2}$KJ/mol.
(5)钒液流电池(如图2所示)具有广阔的应用领域和市场前景,该电池中隔膜只允许H+通过.电池放电时负极的电极反应式为V2+-e-=V3+,电池充电时阳极的电极反应式是VO2+-e-+H2O=VO2++2H+.
(6)用硫酸酸化的H2C2O4溶液滴定(VO2)2SO4溶液,以测定反应①后溶液中的含钒量,反应的离子方程式为:2VO+H2C2O4+2H+═2VO2++2CO2↑+2H2O.取25.00mL 0.1000 mol/LH2C2O4标准溶液于锥形瓶中,加入指示剂,将待测液盛放在滴定管中,滴定到终点时消耗待测液24.0mL,由此可知,该(VO2)2SO4溶液中钒的含量为10.6g/L.
分析 反应①用硫酸溶解含钒固体废弃物(含有SiO2、Al2O3及其他残渣),生成(VO2)2SO4和硫酸铝,SiO2等不溶性杂质过滤除去;反应②是用碳酸钠溶液与(VO2)2SO4和硫酸铝反应,与(VO2)2SO4反应生成NaVO3,碳酸根离子与铝离子水解相互促进生成Al(OH)3沉淀;反应④是NaVO3溶液与氯化铵反应生成NH4VO3沉淀,加热NH4VO3分解为V2O5,据此解答(1)(2)(3);
(4)据已知热化学方程式和待求热化学方程式,利用盖斯定律计算;
(5)钒液流电池放电时负极发生氧化反应,正极发生还原反应,充电时,阳极发生氧化反应;
(6)先据反应方程式和滴定数据计算(VO2)2SO4溶液中c(VO2+)的物质的量浓度,再计算该(VO2)2SO4溶液中钒的含量.
解答 解:(1)用硫酸溶解含钒固体废弃物(含有SiO2、Al2O3及其他残渣),生成(VO2)2SO4和硫酸铝,溶液中的阳离子除氢离子外还有VO2+和Al3+,
故答案为:VO2+和Al3+;
(2)含杂质的(VO2)2SO4溶液用碳酸钠溶液碱浸生成含杂质的NaVO3溶液,Al(OH)3不溶于弱碱,所以反应②碱浸后滤出的固体主要成分是Al(OH)3,
故答案为:Al(OH)3;
(3)据工艺流程图可知,反应④的离子方程式为VO3-+NH4+=NH4VO3,故答案为:VO3-+NH4+=NH4VO3↓;
(4)已知①4Al(s)+3O2(g)═2Al2O3(s)△H1=-a kJ/mol
②4V(s)+5O2(g)═2V2O5(s)△H2=-b kJ/mol
据盖斯定律,(①×5-②×3)÷2得:10Al(s)+3V2O5(s)=5Al2O3(s)+6V(s)△H=-$\frac{5a-3b}{2}$KJ/mol,
故答案为:10Al(s)+3V2O5(s)=5Al2O3(s)+6V(s)△H=-$\frac{5a-3b}{2}$KJ/mol;
(5)钒液流电池放电时负极发生氧化反应,据图可知,电极反应式为V2+-e-=V3+,正极发生还原反应,充电时,阳极发生氧化反应,电极反应式为VO2+-e-+H2O=VO2++2H+;故答案为:V2+-e-=V3+;VO2+-e-+H2O=VO2++2H+;
(6)据滴定数据,结合离子方程式c(VO2+)=$\frac{2×25.0mL×0.100mol/L}{24.0mL}$=0.2083mol/L,所以1L溶液中含V的质量为0.2083mol/L×1L×51g/mol=10.6g,
故答案为:10.6.
点评 本题通过从含钒固体废弃物(含有SiO2、Al2O3及其他残渣)中提取钒的一种新工艺主要流程考查了氢氧化铝的两性、离子方程式书写、盖斯定律、电极反应式书写以及物质含量的计算,题目难度较大.

| A. | CH2=CH2 | B. | CH2=CH-CH=CH2 | C. | 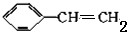 | D. | 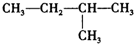 |
| A. | 只能是7 | B. | 只能是15 | C. | 是11或15 | D. | 是11或13 |
CH3CH2CH2COOH+
 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$ +H20
+H20| 相对分子质量 | 密度(g/cm3) | 沸点(℃) | 水中溶解性 | |
| 正丁酸 | 88 | 0.9587 | 163.5 | 溶 |
| 异戊醇 | 88 | 0.8123 | 131 | 微溶 |
| 丁酸异戊酯 | 158 | 0.886 | 179 | 不溶 |

实验步骤:
①如图1连接好装置,在三颈烧瓶中加入0.2mol异戊醇和0.1mol正丁酸、数滴浓硫酸、5mL苯和2~3片碎瓷片,充分摇匀,分水器内加入异戊醇直至与支管相平;
②在122~132℃下回流反应1.5h即可得粗产品;
③冷却后用10%的NaOH溶液中和,用水洗至中性,加入无水硫酸镁后蒸馏得较纯净的丁酸异戊酯11g.
回答下列问题:
(1)图1中A仪器的名称是球形冷凝管或冷凝管,冷却水应从a(选择a或b)口进.
(2)在该实验中,三颈烧瓶的容积最适合的是B(填入正确选项前的字母).
A、50mL B、100mL C、200mL
(3)加入碎瓷片的作用是防止暴沸;如果加热一段时间后发现忘记加瓷片,应该采取的正确操作是A(填入正确选项前的字母).
A、冷却后补加 B、立即补加 C、不需补加 D、重新配料
(4)加入过量异戊醇的目的是提高正丁酸的转化率,分离提纯过程中加入无水硫酸镁的目的是干燥.
(5)如图2,在蒸馏得较纯净的丁酸异戊酯操作中,仪器选择及安装都正确的是c(填标号).
(6)本实验的产率是69.6%.(保留三位有效数字)
 CO的应用和治理是当今社会的热点问题.
CO的应用和治理是当今社会的热点问题.(1)CO能导致镍系催化剂中毒,工业上常用SO2除去原料气中少量CO,生成物为固体S和CO2.写出该反应的化学方程式为2CO+SO2=2CO2+S.
(2)上述反应中,每减少2.24L气体(标准状况下),转移电子数为0.4NA.
CO工业上可用于高炉炼铁,发生如下反应:$\frac{1}{3}$Fe2O3(s)+CO(g)?$\frac{2}{3}$Fe(s)+CO2(g),
已知该反应在不同温度下的平衡常数如表:
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
a.该反应是一个放热反应
b.该反应的平衡常数表达式是K=$\frac{c(C{O}_{2})}{c(CO)}$
c.其他条件不变,向平衡体系充入CO2气体,K值减小
d.当K值等于1时,反应达到平衡
(4)欲提高CO的平衡转化率,促进Fe2O3的转化,可采取的措施是a(选填序号)
a.及时吸收或移出CO2
b.增大反应体系的压强
c.用更高效的催化剂
d.粉碎矿石,增大接触面积
高炉炼铁产生的废气中的CO可进行回收,使其在一定条件下和H2反应制备甲醇:CO(g)+2H2(g)?CH3OH(g)+Q
(5)从上图可以看出,反应开始到平衡,反应速率v(H2)=0.15mol/(L•min).
(6)甲醇氧化可生成甲酸,能使0.1mol/L的甲酸溶液的电离度与pH值都增大的是ad(选填序号)
a.加水稀释 b.加入少量甲酸钠固体 c.通氯化氢 d.加入少量苛性钠固体.




 +NaCl+3H2O.
+NaCl+3H2O. .
. .
.