题目内容
3.NA表示阿伙加德罗常数的值.下列判断正确的是( )| A. | 常温常压下,17g氨气分子所含质子数为10NA | |
| B. | 1mol CL2参加反应,转移电子数一定为2N | |
| C. | 常温常压下,22.4 L C02分子中含有2NA个σ键和2NA个1π键 | |
| D. | 1 L 0.01 mol.L-1的Na2CO3溶液中含有0.01NA个CO2- |
分析 A、求出氨气的物质的量,然后根据氨气是10质子微粒来计算;
B、氯气在反应中可能做氧化剂也可能做还原剂;
C、常温常压下,气体摩尔体积大于22.4L/mol;
D、碳酸根离子是弱酸根离子,在溶液中会水解.
解答 解:A、17g氨气的物质的量为1mol,而氨气是10质子微粒,故1mol氨气中含10mol质子,故A正确;
B、氯气在反应中可能做氧化剂也可能做还原剂,可能被还原为-1价,也可能被氧化为+1或+3或+5或+7价,故转移的电子数不一定是2NA,故B错误;
C、常温常压下,气体摩尔体积大于22.4L/mol,故22.4L二氧化碳气体的物质的量小于1mol,故含有的σ键和π键分别少于2NA个,故C错误;
D、在溶液中碳酸根离子水解,故溶液中的碳酸根的个数小于0.01NA个,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握公式的运用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
13.天然油脂结构的核心为甘油[HOCH2CH(OH)CH2OH],有一瘦身用的非天然油脂,其结构的核心则为蔗糖(C12H22O11).该非天然油脂可由直链型的不饱和油酸(C17H33COOH)与蔗糖反应而得,其反应示意图如图所示(注意图中的反应式不完整).
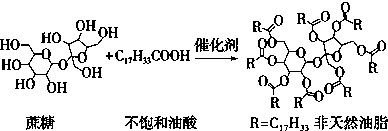
下列说法正确的是( )

下列说法正确的是( )
| A. | 蔗糖酯也是高级脂肪酸的甘油酯,属于油脂类物质 | |
| B. | 该非天然油脂与氢氧化钠溶液共热,其水解产物不与溴水反应 | |
| C. | 非天然油脂为高分子化合物 | |
| D. | 该蔗糖酯在稀硫酸的作用下水解,最终可生成多种有机分子 |
14.NA为阿伏伽德罗常数,下列叙述正确的是(相对原子质量:H-1O-16Mg-24)( )
| A. | 9gH2O中含有NA个电子 | |
| B. | 标准状况下,22.4L乙醇中含有2NA个碳原子 | |
| C. | 25℃,0.2mol•L-1CH3COONa溶液含有0.2NA个CH3COO- | |
| D. | 2.4g镁在空气中充分燃烧生成MgO和Mg3N2,转移0.2NA个电子 |
11.能正确表示下列反应的离子方程式是( )
| A. | Ba(OH)2溶液中加入少量的NaHSO4溶液中:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O | |
| B. | SO2通入NaCO溶液中:SO2+ClO-+2OH-=SO42-+Cl-+H2O | |
| C. | (NH4)2Fe(SO4)2溶液与过量NaOH溶液反应:Fe2++2OH-=Fe(OH)2↓ | |
| D. | 用H2O2从酸化的海带灰浸出液中提取I2:H2O2+2I-=I2+2OH- |
18.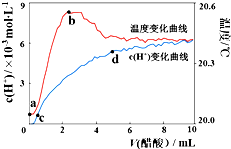 室温下,将10.00mL 5.0000mol•L-1醋酸滴入100.00mL蒸馏水中,溶液中c(H+)和温度随着醋酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将10.00mL 5.0000mol•L-1醋酸滴入100.00mL蒸馏水中,溶液中c(H+)和温度随着醋酸体积变化曲线如图所示.下列有关说法正确的是( )
 室温下,将10.00mL 5.0000mol•L-1醋酸滴入100.00mL蒸馏水中,溶液中c(H+)和温度随着醋酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将10.00mL 5.0000mol•L-1醋酸滴入100.00mL蒸馏水中,溶液中c(H+)和温度随着醋酸体积变化曲线如图所示.下列有关说法正确的是( )| A. | a~b段,醋酸电离过程为放热过程 | |
| B. | c~d段,c(H+)增加,醋酸电离度增加 | |
| C. | c点时,加入等体积等浓度的NaOH溶液则:c(Na+)=c(CH3COO-)+c(CH3COOH) | |
| D. | d点时,c(H+)>c(CH3COOH) |
8.下列表示对于化学反应的离子方程式正确的是( )
| A. | 向含有Fe2O3悬浊液中通入HI:Fe2O3+6H+=2Fe3++3H2O | |
| B. | 误将洁厕灵与84消毒液混合:H++Cl-+HClO=Cl2↑+H2O | |
| C. | 酸性高锰酸钾和过氧化氢制取少量氧气:2MnO4-+12H++4H2O2═4Mn2++7O2↑+10H2O | |
| D. | 用0.3mol/L的氯化铵溶液除去氢氧化铝中少量的氢氧化镁:Mg(OH)2+2NH4+=Mg2++2NH3•H2O |
15. 铁、铝、铜及其化合物在生产、生活中有着广泛的应用.请回答下列问题:
铁、铝、铜及其化合物在生产、生活中有着广泛的应用.请回答下列问题:
(1)铝离子的结构示意图为 .
.
(2)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,该反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+.
(3)氢氧化铝是医用的胃酸中和剂的一种.用离子方程式表示其作用机理是Al(OH)3+3H+=Al3++3H2O.
(4)与明矾相似,硫酸铁也可用作絮凝剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是Fe3++3H2O?Fe(OH)3(胶体)+3H+酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体.
(5)下表中,对陈述Ⅰ、Ⅱ的正确性的判断都正确的是B (填字母序号).
(6)钢铁的析氢腐蚀简单示意图如图所示,正极的电极反应式为2H++2e-=H2↑.该图某处稍作修改即可成为钢铁电化学防护的简单示意图,其中一种方法是将C换成Zn等比Fe活泼的金属,请完善另一种方法的示意图.
 铁、铝、铜及其化合物在生产、生活中有着广泛的应用.请回答下列问题:
铁、铝、铜及其化合物在生产、生活中有着广泛的应用.请回答下列问题:(1)铝离子的结构示意图为
 .
.(2)制造电路板的工艺中,FeCl3溶液可以蚀刻铜箔,该反应的离子方程式为2Fe3++Cu=2Fe2++Cu2+.
(3)氢氧化铝是医用的胃酸中和剂的一种.用离子方程式表示其作用机理是Al(OH)3+3H+=Al3++3H2O.
(4)与明矾相似,硫酸铁也可用作絮凝剂,在使用时发现硫酸铁并不能使酸性废水中的悬浮物沉降除去,其原因是Fe3++3H2O?Fe(OH)3(胶体)+3H+酸性废水抑制Fe3+的水解,使其不能生成有吸附作用的Fe(OH)3胶体.
(5)下表中,对陈述Ⅰ、Ⅱ的正确性的判断都正确的是B (填字母序号).
| 选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
| A | 铁是地壳中含量最高的金属元素 | 铁是人类最早使用的金属材料 | Ⅰ对;Ⅱ对. |
| B | 常温下铁与稀硫酸反应生成氢气 | 高温下氢气能还原氧化铁生成铁 | Ⅰ对;Ⅱ对. |
| C | 铁比铝更易锈蚀 | 铝比铁活泼 | Ⅰ错;Ⅱ对. |
| D | 铝在空气中表面生成致密氧化膜 | 可用铝罐储存运输浓硫酸、浓硝酸 | Ⅰ错;Ⅱ对. |
12.某直链一元醇14g能与金属钠完全反应,生成0.2克H2,则此醇的同分异构体数目为( )
| A. | 6个 | B. | 7个 | C. | 8个 | D. | 9个 |
14.LiFePO4电池具有稳定性高、安全、对环境友好等优点,可用于电动汽车.电池反为:FePO4+Li═LiFePO4,电池的正极材料是LiFePO4,负极材料是石墨,含Li+导电固体为电解质.下列有关LiFePO4电池说法正确的是( )
| A. | 可加入硫酸以提高电解质的导电性 | |
| B. | 放电时电池内部Li+向负极移动 | |
| C. | 充电过程中,电池正极材料的质量增加 | |
| D. | 放电时电池正极反应为:FePO4+Li++e-═LiFePO4 |