题目内容
14.NA为阿伏伽德罗常数,下列叙述正确的是(相对原子质量:H-1O-16Mg-24)( )| A. | 9gH2O中含有NA个电子 | |
| B. | 标准状况下,22.4L乙醇中含有2NA个碳原子 | |
| C. | 25℃,0.2mol•L-1CH3COONa溶液含有0.2NA个CH3COO- | |
| D. | 2.4g镁在空气中充分燃烧生成MgO和Mg3N2,转移0.2NA个电子 |
分析 A、求出水的物质的量,然后根据水为10电子微粒来分析;
B、标况下,乙醇为液体;
C、CH3COO-是弱酸根离子,在溶液中会水解;
D、求出镁的物质的量,然后根据反应后镁的价态变为+2价来计算.
解答 解:A、9g水的物质的量为0.5mol,而水为10电子微粒,故0.5mol水中含5mol电子,故A错误;
B、标况下,乙醇为液体,不能根据气体摩尔体积来计算,故B错误;
C、CH3COO-是弱酸根离子,在溶液中会水解,故溶液中CH3COO-的个数小于0.2NA个,故C错误;
D、2.4g镁的物质的量为0.1mol,而反应后镁的价态变为+2价,故0.1mol镁转移0.2mol电子,转移0.2NA个电子,故D正确.
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,掌握公式的运用和物质的结构是解题关键,难度不大.

练习册系列答案
相关题目
4.短周期元素X、Y、Z、W的原子序数依次增大,且原子最外层电子数之和为13.X与W同主族,Z是地壳中含量最高的元素.下列说法正确的是( )
| A. | 原子半径的大小顺序:r(Y)>r(Z)>r(W) | |
| B. | X和Y两元素一定不在同一周期 | |
| C. | 元素Z、W的简单离子的电子层结构相同 | |
| D. | X、W两元素一定能形成两种组成不同的氧化物 |
5.设nA为阿伏加德罗常数的数值,下列说法正确的是( )
| A. | 1mol苯中含有3nA个碳碳双键 | |
| B. | 标准状况下,22.4 L乙烯和丙烯混合气体中所含的分子数目为2nA | |
| C. | 1mol Cl2与足量Fe粉反应生成FeCl3,转移2nA个电子 | |
| D. | 1L 0.1 mol•L-1 Na2S溶液中含有0.1nA个S2- |
2.用NaOH溶液吸收烟气中的SO2,将所得的Na2SO3溶液进行电解,可循环再生NaOH同时得到某种副产物,其原理如图所示(电极材料为石墨).下列说法不正确的是( )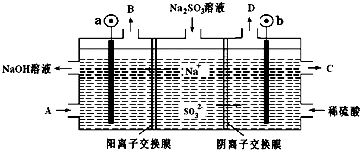

| A. | b电极上的主反应是 SO32--2e-+H2O═SO42-+2H+ | |
| B. | 若D是混合气体,则可能含有SO2、O2等成分 | |
| C. | a 电极发生还原反应,当有1mol Na+通过阳离子交换膜时,a极生成11.2L气体 | |
| D. | A溶液是稀NaOH溶液,作用是增强溶液的导电性;C是较浓的硫酸溶液 |
9.下列说法正确的是( )
| A. | 常温下,反应4Fe(OH)2(s)+2H2O(l)+O2(g)═4Fe(OH)3(s)能自发进行,证明该反应的△H<0 | |
| B. | 常温下,BaSO4分别在相同物质的量浓度的Na2SO4溶液和Al2(SO4)3溶液中的溶解度相同 | |
| C. | 常温下,向饱和Na2CO3溶液中加少量BaSO4粉末,过滤,向洗净的沉淀中加稀盐酸,有气泡产生,说明常温下Ksp(BaCO3)<Ksp(BaSO4) | |
| D. | 等体积、等物质的量浓度的NH3•H2O溶液与NH4Cl溶液混合后溶液呈碱性,说明NH3•H2O的电离程度小于NH${\;}_{4}^{+}$的水解程度 |
19.下列说法不正确的是( )
| A. | 发展核电、煤中加入生石灰、利用二氧化碳制造全降解塑料都能有效减少环境污染 | |
| B. | 物质变化中炭化、钝化、皂化、酯化、熔化都属于化学变化 | |
| C. | 氢键、分子间作用力、离子键和共价键均为微粒间的相互作用力 | |
| D. | 农业废弃物、城市工业有机废弃物及动物粪便中都蕴藏着丰富的生物质能 |
6.在固定容积的密闭容器中,可逆反应2X(g)+2Y(s)?3Z(g),达到平衡后,若将容器中X、Y、Z的物质的量均减少一半,对该反应产生的影响是( )
| A. | 正、逆反应速率都减小,平衡不移动 | |
| B. | 正、逆反应速率都减小,平衡向正反应方向移动 | |
| C. | 正反应速率增大,逆反应速率减小,平衡向正反应方向移动 | |
| D. | 正反应速率减小,逆反应速率增大,平衡向逆反应方向移动 |
3.NA表示阿伙加德罗常数的值.下列判断正确的是( )
| A. | 常温常压下,17g氨气分子所含质子数为10NA | |
| B. | 1mol CL2参加反应,转移电子数一定为2N | |
| C. | 常温常压下,22.4 L C02分子中含有2NA个σ键和2NA个1π键 | |
| D. | 1 L 0.01 mol.L-1的Na2CO3溶液中含有0.01NA个CO2- |
5.在一定温度下,将气体X和气体Y各0.16mol充入10L 恒容密闭容器中,发生反应:X(g)+Y(g)═2Z(g)△H<0,一段时间后达到平衡.反应过程中测定的数据如下表:下列说法正确的是( )
| t/min | 2 | 4 | 7 | 9 |
| n(Y)/mol | 0.12 | 0.11 | 0.10 | 0.10 |
| A. | 反应前2min的平均速率ν(Z)=2.0×10-5 mol/(L•min) | |
| B. | 4min时,ν(逆)>ν(正) | |
| C. | 该温度下,此反应的平衡常数K=1.44 | |
| D. | 7min时,反应还未达到平衡状态 |