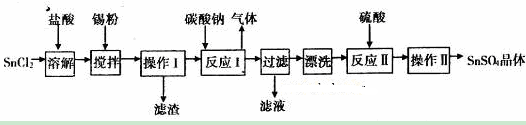
题目内容
乙二酸(H2C2O4)俗称草酸,是一种重要的化工原料。查阅资料,了解到以下有关信息:
①乙二酸易溶于水,加热至100℃开始升华,125℃时迅速升华,157℃时大量升华并开始分解。乙二酸受热分解生成水、二氧化碳和一种常见的还原性气体。
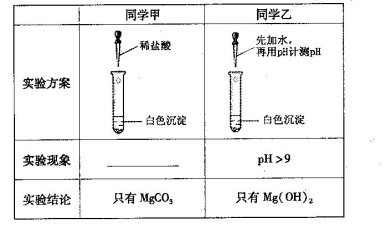
②乙二酸的钙盐——乙二酸钙为不溶于水的白色晶体。某校化学研究性学习小组为探究草酸的部分性质,进行了如下实验:
(1)为比较相同浓度的草酸和硫酸的导电性,实验室需配制100 mL 0.1mol/L的草酸溶液,配制过程中用到的玻璃仪器有量筒、烧杯、玻璃棒、_____ 、____。
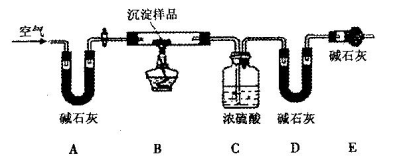
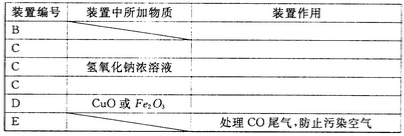
(2)化学兴趣小组的同学用实验证明乙二酸晶体受热分解生成的气体成分。他们利用下图提供的装置,自选试剂,提出了下列实验方案:按A→B→C→C→C→D→E顺序从左至右连接装置,检验乙二酸晶体受热分解生成的气体成分。请你按整套装置从左至右的顺序填写下表中的空格: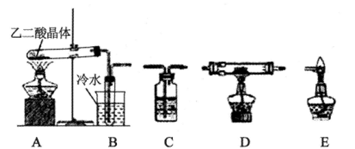
①请写出乙二酸受热分解的化学方程式 _______。
②上述实验中能说明乙二酸热分解生成了还原性气体的实验现象是____。
③检验乙二酸具有较强的还原性,通常选用的试剂是____。
(1)100mL容量瓶 、 胶头滴管装置编号 装置中所加物质 装置作用 B 检验H2O(g):冷却凝固乙二酸蒸汽,防止进入澄清石灰水影响CO2的检验 C 澄清石灰水 检验CO2 C 吸收多余的CO2 C 浓硫酸 吸收水蒸气 D 检验CO E
① H2C2O4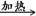 H2O+CO↑+CO2↑
H2O+CO↑+CO2↑
②D装置中的CuO由黑色变红色(或D装置中的Fe2O3由红色变黑色),E装置导管口气体燃烧
③酸性高锰酸钾溶液或高锰酸钾或KMnO4
解析试题分析:(1)实验室在配制100 mL 0.1mol/L的草酸溶液的过程中用到的玻璃仪器有量筒、烧杯、玻璃棒、100ml的容量瓶、胶头滴管。(2)B的作用:由于乙二酸受热容易升华,所以降温可冷却凝固乙二酸蒸汽,防止进入澄清石灰水影响CO2的检验,同时可以检验H2O(g)的存在。第一次使用C 装置盛有澄清的石灰水,目的是为了检验产物中含有CO2。第二次使用C装置盛有NaOH容易,目的是为了除去CO2气体。第三次装置中盛有浓硫酸,目的是为了吸收H2O蒸汽。防止干扰CO的检验 。盛有Fe2O3或CuO的装置是为了检验CO的存在。因为CO有毒,是大气污染物,使用在排放到空气之前先用E将其点燃处理掉,变为无害的气体。①根据题意结合质量守恒定律可得草酸分解的化学方程式为:H2C2O4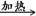 H2O+CO↑+CO2↑②上述实验中能说明乙二酸热分解生成了还原性气体的实验现象是D装置中的CuO由黑色变红色(或D装置中的Fe2O3由红色变黑色),③由于乙二酸具有较强的还原性,所以经常使用有强氧化性的物质如酸性高锰酸钾溶液、重铬酸钾溶液等来检验其还原性。
H2O+CO↑+CO2↑②上述实验中能说明乙二酸热分解生成了还原性气体的实验现象是D装置中的CuO由黑色变红色(或D装置中的Fe2O3由红色变黑色),③由于乙二酸具有较强的还原性,所以经常使用有强氧化性的物质如酸性高锰酸钾溶液、重铬酸钾溶液等来检验其还原性。
考点:考查乙二酸的物理性质、化学性质、不稳定性及分解产物的检验的方法、顺序、现象等知识。

 科学实验活动册系列答案
科学实验活动册系列答案某废液中含有大量的K+、Cl-、Br-,还有少量的Ca2+、Mg2+、SO42-。某研究性学习小组利用这种废液来制取较纯净的氯化钾晶体及液溴(Br2),设计了如下流程图: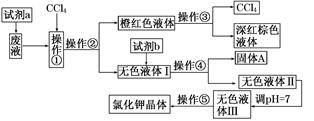
可供选择的试剂:饱和Na2CO3溶液,饱和K2CO3溶液、KOH溶液、BaCl2溶液、Ba(NO3)2溶液、H2O2溶液、KMnO4溶液(H+)、稀盐酸。
请根据流程图,回答相关问题:
(1)试剂a应该选用________。
(2)操作①②③④⑤的名称是________(填序号)。
| A.萃取、过滤、分液、过滤、蒸发结晶 |
| B.萃取、分液、蒸馏、过滤、蒸发结晶 |
| C.分液、萃取、过滤、过滤、蒸发结晶 |
| D.萃取、分液、分液、过滤、蒸发结晶 |
(4)调节pH的作用是________,操作方法是_____________________________________
________________________________________________________________________。
(5)操作⑤中用到的瓷质仪器名称是__________________________________________。
硫酸铜受热分解生成氧化铜和气体,加热温度不同,气体成分也不同。气体成分可能含SO2、SO3和O2中的一种、两种或三种。某化学课外活动小组通过设计探究性实验,测定反应产生的SO2、SO3和O2的物质的量,并计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式。实验用到的仪器如下图所示:
[提出猜想]
Ⅰ.所得气体的成分可能只含SO3一种;
Ⅱ.所得气体的成分可能含有________两种;
Ⅲ.所得气体的成分可能含有________三种。
[实验探究]
实验操作过程略。已知实验结束时,硫酸铜完全分解。
(1)请你组装探究实验的装置,按从左至右的方向,各仪器接口的连接顺序为①→⑨→⑩→⑥→⑤→________→________→________→________→②(填接口序号)。
(2)若实验结束时B中量筒没有收集到水,则证明猜想________正确。
(3)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后测得相关数据也不同,数据如下:
| 实验 小组 | 称取CuSO4 的质量/g | 装置C增加 的质量/g | 量筒中水的体积折算成标准状况下气体的体积/mL |
| 一 | 6.4 | 2.56 | 448 |
| 二 | 6.4 | 2.56 | 224 |
请通过计算,推断出第一小组和第二小组的实验条件下CuSO4分解的化学方程式。
第一小组:________________________________________________________;
第二小组:________________________________________________________。
苯甲酸是一种重要的化工产品,某学习小组设计方案制备苯甲酸。反应原理如下: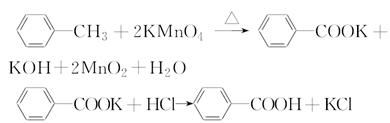
已知甲苯的熔点为-95℃,沸点为110.6℃,易挥发,密度为0.866 g·cm-3;苯甲酸的熔点为122.4℃,在25℃和95℃下溶解度分别为0.3 g和6.9 g。
【制备产品】 30.0 mL甲苯和25.0 mL 1 mol·L-1高锰酸钾溶液在80℃下反应30 min,装置如图所示:
(1)图中支管的作用是_______________________。
(2)冷凝管的作用是________;进水口为________(填“a”或“b”)。
(3)相对于用酒精灯直接加热,用沸水浴加热的优点是________;在本实验中,三颈烧瓶最合适的容积是________(填字母)。
| A.50 mL | B.100 mL | C.200 mL | D.250 mL |
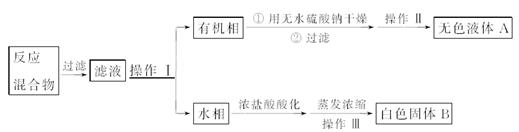
(4)操作Ⅰ的名称是________;含有杂质的产物经操作Ⅱ进一步提纯得无色液体A,则操作Ⅱ的名称是________。
(5)操作Ⅲ的名称是________。检验B中是否含有Cl-的方法如下:取少量B溶于水,在上层清液中滴加稀硝酸酸化的________溶液,若产生白色沉淀,则B中含有Cl-。
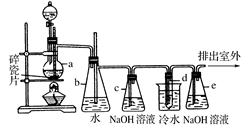
某种粗盐中含有泥沙、Ca2+、Mg2+、Fe3+、SO等杂质。某同学在实验室中设计了用这种粗盐制备精盐的方案如下(用于沉淀的试剂稍过量):
请回答以下问题:
(1)为操作Ⅳ选择所需仪器(用标号字母填写):________。
| A.烧杯 | B.试管 | C.玻璃棒 | D.分液漏斗 E.漏斗 F.酒精灯 |
(2)操作Ⅲ中常用Na2CO3溶液、NaOH溶液、BaCl2溶液作为除杂试剂,则加入除杂试剂的顺序为:NaOH溶液→________→________。
(3)操作Ⅲ中,判断加入BaCl2已过量的方法是_________________________。
(4)操作Ⅴ应选择的酸是________,若将操作Ⅴ与操作Ⅳ的先后顺序对调,将会对实验结果产生的影响是__________________________________________。
(5)操作Ⅵ是________(选择合理操作的名称,用标号字母按操作先后顺序填写)。
a.过滤、洗涤 b.蒸发、浓缩 c.萃取、分液 d.冷却、结晶