题目内容
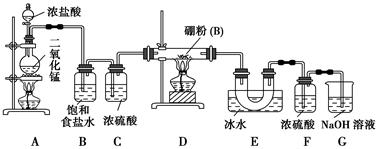
(13分)某研究性学习小组欲探究Na2CO3溶液与MgCl2溶液反应产生白色沉淀的成分,小组成员做如下实验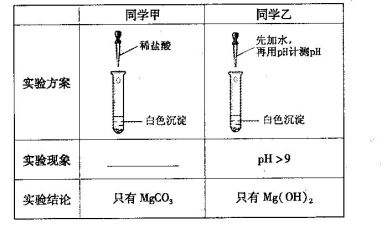
(1)若按所得的结论分析,甲观察到的实验现象是___________________________。
(2)在探究沉淀物成分前,甲、乙都将沉淀物从溶液中分离出来,洗涤并干燥。同学丙认为他们并未将沉淀洗涤干净,请用简单的实验证明丙的观点。
(3)同学丁认为甲结论不合理,理由是Ksp(MgCO3)___Ksp [Mg(OH)2](选填“<”或“>”),所以沉淀物未必是MgCO3。经查阅资料得知:该白色沉淀的组成应为Mgx(OH)y(CO3)z·nH2O。为确定沉
淀物的具体组成,他设计下图装置进行实验(所有夹持装置已省略)。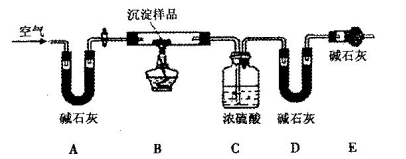
(4)请将丁设计的实验步骤补充完整:
①检查装置气密性;
②先装入药品,并称量相关装置的质量,后连接各装置;
③________________________________________________________;
④停止加热,持续通入空气直至实验结束,再次称量步骤②中相关装置的质量。
(5)装置E中碱石灰的作用是_________________________________________________。
三次实验所得数据如下:(部分数据已换算为相应的物质的量)
(6)分析实验数据可知,第_________组出现误差较大的数据,应舍去。由实验数据计算
得该白色沉淀物的组成为___________(选填序号)。
a.Mg2(OH)2CO3·3H2O b.Mg(OH)2(CO3)2·3H2O
c.Mg4(OH)2(CO3)3·3H2O d.Mg5(OH)4(CO3)3·2H2O
(1)沉淀溶解,有气泡产生(2分)
(2)取最后一次洗涤液于另一试管中,加入硝酸酸化的硝酸银溶液,出现白色沉淀。(2分,或取最后一次洗涤液,用焰色反应检验存在的钠离子。答案合理即可得分) (3)>(2分)
(4)先通入一会儿空气,再加热(2分) (5)防止空气中的水蒸气和CO2进入装置D(2分)
(6)3(1分) c(2分)
解析试题分析:(1)碳酸镁与稀盐酸反应生成氯化镁、水和CO2,因此实验现象是沉淀溶解,有气泡产生。
(2)由于沉淀表面有吸附的氯离子,所以可以通过检验氯离子来判断沉淀是否洗涤干净,即取最后一次洗涤液于另一试管中,加入硝酸酸化的硝酸银溶液,出现白色沉淀即证明没有洗涤干净。
(3)由于氢氧化镁的溶度积常数小于碳酸镁的溶度积常数,所以Ksp(MgCO3)>Ksp [Mg(OH)2]。
(4)由于装置中有残留的空气,而空气中通过碱石灰时水蒸气和CO2被吸收,所以因此先通入一会儿空气,再加热。
(5)由于空气中还含有水蒸气和CO2会进入装置D干扰实验,所以E装置中碱石灰的作用是防止空气中的水蒸气和CO2进入装置D。
(6)由于水蒸气和CO2的物质的量与样品的质量成比例,因此根据实验1、2中的数据可知,实验3中水蒸气的物质的量偏大(应该是0.12mol),应该舍去。根据表中数据可知CO2与水蒸气的物质的量之比是3:4,则a.Mg2(OH)2CO3·3H2O中CO2与水蒸气的物质的量之比是1:4,a不正确; b.Mg(OH)2(CO3)2·3H2O中CO2与水蒸气的物质的量之比是1:2,b不正确;c.Mg4(OH)2(CO3)3·3H2O中CO2与水蒸气的物质的量之比是3:4,c正确;d.Mg5(OH)4(CO3)3·2H2O中CO2与水蒸气的物质的量之比是3:4,但3.64g该物质得不到0.03molCO2,d不正确,答案选c。
考点:考查实验方案设计与评价、物质检验、实验数据处理

 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案(17分)(2012?广东)苯甲酸广泛应用于制药和化工行业,某同学尝试用甲苯的氧化反应制备苯甲酸,反应原理: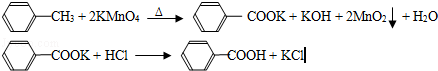
实验方法:一定量的甲苯和KMnO4溶液在100℃反应一段时间后停止反应,按如下流程分离出苯甲酸和回收未反应的甲苯.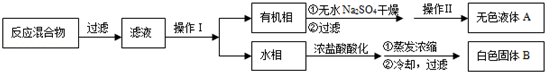
已知:苯甲酸分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3g和6.9g;纯净固体有机物都有固定熔点.
(1)操作Ⅰ为 ,操作Ⅱ为 .
(2)无色液体A是 ,定性检验A的试剂是 ,现象是
(3)测定白色固体B的熔点,发现其在115℃开始熔化,达到130℃时仍有少量不熔,该同学推测白色固体B是苯甲酸与KCl的混合物,设计了如下方案进行提纯和检验,实验结果表明推测正确.请在答题卡上完成表中内容.
| 序号 | 实验方案 | 实验现象 | 结论 |
| ① | 将白色固体B加入水中,加热溶解, _________ _________ | 得到白色晶体和无色溶液 | |
| ② | 取少量滤液于试管中, _________ | 生成白色沉淀 | 滤液含Cl﹣ |
| ③ | 干燥白色晶体, _________ | _________ | 白色晶体是苯甲酸 |
三苯甲醇(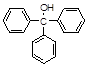 )是一种重要的化工原料和医药中间体,实验室合成三苯甲醇其合成流程如图1所示,装置如图2所示。
)是一种重要的化工原料和医药中间体,实验室合成三苯甲醇其合成流程如图1所示,装置如图2所示。
已知:(Ⅰ)格氏试剂容易水解,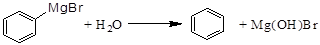 (碱式溴化镁);
(碱式溴化镁);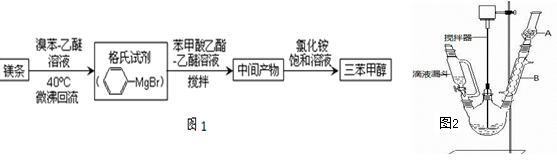
(Ⅱ)相关物质的物理性质如下:
| 物质 | 熔点 | 沸点 | 溶解性 |
| 三苯甲醇 | 164.2℃ | 380℃ | 不溶于水,溶于乙醇、乙醚等有机溶剂 |
| 乙醚 | -116.3℃ | 34.6℃ | 微溶于水,溶于乙醇、苯等有机溶剂 |
| 溴苯 | -30.7°C | 156.2°C | 不溶于水,溶于乙醇、乙醚等多数有机溶剂 |
| 苯甲酸乙酯 | -34.6°C | 212.6°C | 不溶于水 |
| Mg(OH)Br | 常温下为固体 | 能溶于水,不溶于醇、醚等有机溶剂 | |
(Ⅲ)三苯甲醇的分子量是260,纯净固体有机物一般都有固定熔点。
请回答以下问题:
(1)图2中玻璃仪器B的名称: ;装有无水CaCl2的仪器A的作用是 ;
(2)图2中滴加液体未用普通分液漏斗而用滴液漏斗的作用是 ;制取格氏试剂时要保持微沸,可以采用 (方式)加热,优点是 ;
(3)制得的三苯甲醇粗产品中,含有乙醚、溴苯、苯甲酸乙酯等有机物和碱式溴化镁等杂质,可以设计如下提纯方案,请填写如下空白:
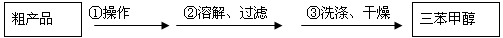
其中,①操作为: ;洗涤液最好选用: (从选项中选);
A、水 B、乙醚 C、乙醇 D、苯
检验产品已经洗涤干净的操作为: 。
(4)纯度测定:称取2.60g产品,配成乙醚溶液,加入足量金属钠(乙醚与钠不会反应),充分反应后,测得生成气体体积为100.80ml标准状况)。产品中三苯甲醇质量分数为 (保留两位有效数字)。
溴乙烷是一种重要的化工合成原料。实验室合成溴乙烷的反应和实验装置如下:
反应:CH3CH2OH+HBr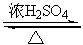 CH3CH2Br+H2O
CH3CH2Br+H2O
装置:
实验中可能用到的数据如下表:
| 物质 | 相对分子质量 | 沸点/℃ | 密度/g/cm3 | 水溶性 |
| CH3CH2OH | 46 | 78.4 | 0.79 | 互溶 |
| CH3CH2Br | 109 | 38.4 | 1.42 | 难溶 |
| CH3CH2OCH2CH3 | 74 | 34.5 | 0.71 | 微溶 |
| CH2=CH2 | 28 | -103.7 | 0.38 | 不溶 |
| 浓硫酸(H2SO4) | 98 | 338.0 | 1.38 | 易溶 |
①合成反应:在仪器B中加入适量NaBr、浓硫酸和50mL乙醇,安装好仪器,缓缓加热,收集馏出物。
②分离提纯:将馏出物加水后振荡,再加入适量酸除去乙醚,分液,最后得到52mL溴乙烷。
回答下列问题:
(1)仪器B的名称是___________。
(2)仪器C为直形冷凝管,冷水进口是___________(填“a”或“b”)。
(3)仪器D置于盛有_________的烧杯中,目的是__________________________________。
(4)装置A的名称为牛角管,其结构中的c支管的作用是___________________________。
(5)溴乙烷粗产品分离提纯阶段,加水的目的是___________________________________。
(6)该实验所得溴乙烷的产率为 ________________________。
碘是人体必需的微量元素之一,有“智力元素”之称。食用加碘食盐可预防碘缺乏病。查阅资料知:
①在酸性条件下,I-能被N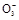 氧化成I
氧化成I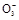 ,被H2O2或O2等氧化成I2;
,被H2O2或O2等氧化成I2;
②I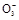 能被HS
能被HS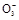 还原成I2。
还原成I2。
请你利用实验室常用仪器和下列限选试剂,依次研究某食盐样品中所加碘的存在形式是I2、I-、I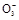 中的哪一种。
中的哪一种。
限选试剂如下:1.0 mol·L-1 HNO3溶液、1.0 mol·L-1 H2SO4溶液、1.0 mol·L-1 NaHSO3溶液、3% H2O2溶液、1%淀粉溶液、蒸馏水
Ⅰ.提出假设
假设1:该食盐样品中含I2;
假设2:该食盐样品中含I-;
假设3: 。
Ⅱ .设计方案与实验探究
将适量食盐样品溶于蒸馏水制成溶液,请按要求填写下表。
| 实验步骤 | 预期现象与结论 |
| 步骤1:取少量上述溶液注入试管中,滴入几滴淀粉溶液振荡 | 若溶液显 ,则假设1成立;否则,假设1不成立,再进行步骤2 |
| 步骤2: | 若溶液显蓝色,则假设2成立,反应的离子方程式为 ; 否则,假设2不成立,再进行步骤3 |
| 步骤3: | |
Ⅲ.问题与思考
纯的KIO3或KI都可以作为食用加碘盐中碘的来源。从化学角度来看,食盐中添加 (填“KIO3”或“KI”)更好;理由是 。
硫酸铜是一种应用广泛的化工原料,实验室中可通过不同途径制取硫酸铜溶液和胆矾(CuSO4·5H2O),其中一种流程如下:
(1)操作Ⅰ具体为 、 、过滤、烘干。
(2)杂铜(含少量有机物)灼烧后的产物除氧化铜还含少量铜,原因可能是 (填字母代号)。
| A.灼烧过程中部分氧化铜被还原 |
| B.灼烧不充分,铜未被完全氧化 |
| C.氧化铜在加热过程中分解生成铜 |
| D.该条件下铜无法被氧气氧化 |
(4)通过下述图1装置也可制取硫酸铜溶液(已知:2NaOH+2NO2
 NaNO3+NaNO2+H2O)。
NaNO3+NaNO2+H2O)。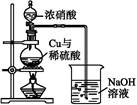
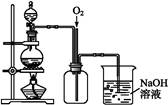
图1 图2
烧瓶内发生反应的离子方程式为 ;
图2是图1的改进装置,其优点有:① ;② 。

 BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。