题目内容
硫酸亚锡(SuSO4)是一种重要的硫酸盐,广泛应用于镀锡工业。某研究小组设计SnSO4制备路线如下:
查阅资料:
I.酸性条件下,锡在水溶液中有Sn2+、Sn4+两种主要存在形式,Sn2+易被氧化。
II.SnC12易水解生成碱式氯化亚锡[Sn(OH)Cl]。
回答下列问题:
(1)SnC12粉末需要加浓盐酸进行溶解,请用化学方程式说明原因___________________。
(2)在SnC12溶液中加入Sn粉的作用有两个:①调节溶液pH ②_________________。
(3)操作I中使用的玻璃仪器有___________________。
(4)该小组通过下列方法测定所用锡粉的纯度(杂质不参与反应):
①将试样溶于盐酸中,发生的反应为:Sn+2HCl═SnCl2+H2↑;
②加入过量的FeCl3,发生的反应为:SnCl2+ FeCl3= SnCl4+ FeCl2
③用已知浓度的K2Cr2O7滴定生成的Fe2+,发生的反应为:6FeCl2+K2Cr2O7+14HCl═6FeCl3+2KCl+2CrCl3+7H2O
滴定时,K2Cr2O7溶液应该装在____________(填“酸式”或“碱式”)滴定管中。
若取2.0g锡粉,经上述各步反应后,共用去0.100mol/L K2Cr2O7溶液40.00mL,锡粉中锡的质量分数是____________________。
(1)SnCl2+H2O Sn(OH)Cl+HCl(2)防止Sn2+被氧化(3)漏斗、玻璃棒、烧杯(4)酸式;71.4%
Sn(OH)Cl+HCl(2)防止Sn2+被氧化(3)漏斗、玻璃棒、烧杯(4)酸式;71.4%
解析试题分析:(1)SnCl2易水解生成碱式氯化亚锡,存在平衡SnCl2+H2O Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解;(2)由题意知Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;(3)由流程图可知,操作Ⅰ是从溶液中得到含结晶水的晶体,只能采取蒸发浓缩、冷却结晶、过滤、洗涤得到,故用到的玻璃仪器为漏斗、玻璃棒、烧杯;(4)碱式滴定管的胶管与重铬酸钾溶液会有一定的氧化和吸附,影响浓度;令锡粉中锡的质量分数为x,则:
Sn(OH)Cl+HCl,加入盐酸,使该平衡向左移动,抑制Sn2+水解;(2)由题意知Sn2+易被氧化,加入Sn粉除调节溶液pH外,还防止Sn2+被氧化;(3)由流程图可知,操作Ⅰ是从溶液中得到含结晶水的晶体,只能采取蒸发浓缩、冷却结晶、过滤、洗涤得到,故用到的玻璃仪器为漏斗、玻璃棒、烧杯;(4)碱式滴定管的胶管与重铬酸钾溶液会有一定的氧化和吸附,影响浓度;令锡粉中锡的质量分数为x,则:
Sn~Sn2+~2Fe3+~2Fe2+~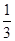 K2Cr2O7计算.
K2Cr2O7计算.
119g 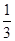 mol
mol
2.0g×x 0.100mol/L×0.040L
故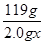 =
=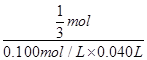
解得x=71.4%,
考点:化学方程式的有关计算;物质分离和提纯的方法和基本操作综合应用;制备实验方案的设计

 活力课时同步练习册系列答案
活力课时同步练习册系列答案硫酸铜是一种应用广泛的化工原料,实验室中可通过不同途径制取硫酸铜溶液和胆矾(CuSO4·5H2O),其中一种流程如下:
(1)操作Ⅰ具体为 、 、过滤、烘干。
(2)杂铜(含少量有机物)灼烧后的产物除氧化铜还含少量铜,原因可能是 (填字母代号)。
| A.灼烧过程中部分氧化铜被还原 |
| B.灼烧不充分,铜未被完全氧化 |
| C.氧化铜在加热过程中分解生成铜 |
| D.该条件下铜无法被氧气氧化 |
(4)通过下述图1装置也可制取硫酸铜溶液(已知:2NaOH+2NO2
 NaNO3+NaNO2+H2O)。
NaNO3+NaNO2+H2O)。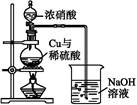
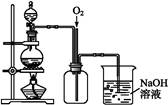
图1 图2
烧瓶内发生反应的离子方程式为 ;
图2是图1的改进装置,其优点有:① ;② 。
粗CuO是将工业废铜、废铜合金等高温焙烧而成的,杂质主要是铁的氧化物及泥沙。以粗CuO为原料制备胆矾的主要流程如下: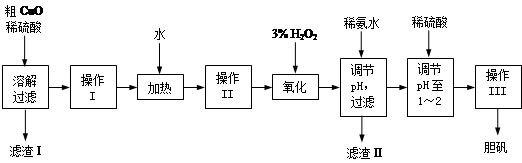
经操作I得到粗胆矾,操作III得到精制胆矾。两步操作相同,具体包括蒸发浓缩、冷却结晶、过滤、洗涤、干燥等步骤。
已知: 、
、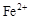 、
、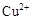 转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如下表:
转化为相应氢氧化物时,开始沉淀和沉淀完全时的pH如下表:
| |  | 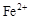 | 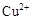 |
| 开始沉淀时的pH | 2.7 | 7.6 | 5.2 |
| 完全沉淀时的pH | 3.7 | 9.6 | 6.4 |
(1)溶解、过滤需要用到玻璃棒,它的作用是 。
(2)写出加入3% H2O2后发生反应的离子方程式 。(原溶液显酸性)。
(3)加稀氨水调节pH应调至范围 。下列物质可用来替代稀氨水的是 。(填字母)
A.NaOH B.Cu(OH)2 C.CuO D.NaHCO3
(4)操作III析出胆矾晶体后,溶液中还可能存在的溶质为CuSO4、H2SO4、________________。
(5)某学生用操作III所得胆矾进行“硫酸铜晶体结晶水含量”的测定,数据记录如下表所示:
| | 第一次实验 | 第二次实验 |
| 坩埚质量(g) | 14.520 | 14.670 |
坩埚质量 晶体质量(g) 晶体质量(g) | 17.020 | 18.350 |
| 第一次加热、冷却、称量(g) | 16.070 | 16.989 |
| 第二次加热、冷却、称量(g) | 16.070 | 16.988 |
(填字母)。
A.加热前称量时坩埚未完全干燥 B.该胆矾中含有受热不分解的杂质
C.加热后坩埚放在干燥器中冷却 D.玻璃棒上沾有的固体未刮入坩埚
硫酸铜受热分解生成氧化铜和气体,受热温度不同,该气体成分也不同。气体成分可能含SO2、SO3和O2中的一种、二种或三种.某化学课外活动小组通过设计一探究性实验,测定反应产生的SO2、SO3和O2的物质的量,并经计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式。实验用到的仪器如右图所示: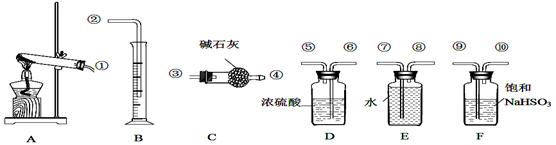
【提出假设】
Ⅰ.所得气体的成分可能只含_________一种;
Ⅱ.所得气体的成分可能含有____________________二种;
Ⅲ.所得气体的成分可能含有SO2、SO3、O2三种。
【实验探究】实验操作过程(略)已知实验结束时,硫酸铜完全分解。
(1)请你组装探究实验的装置,按从左至右的方向,各仪器接口连接顺序为①⑨⑩______________(填序号、仪器不重复使用)。
(2)实验过程中,仪器F的作用是 。
【验证假设,分析推理】
(3)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后测得相关数据也不同.数据如下:
| 实验 小组 | 称取无水CuSO4的质量/g | 仪器C增加的质量/g | 量筒中水的体积折算标准状况下气体的体积/mL |
| ① | 6.4 | 2.56 | 224 |
| ② | 6.4 | 2.56 | 448 |
请通过计算,推断出第②小组CuSO4分解的化学反应方程式: 。
若将①小组CuSO4分解时所得气体在一定条件下反应并达到平衡,恢复到反应前的温度和压强时,测得密度是反应前的
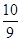 ,其平衡常数表达式为 最终所得气体的平均相对分子质量为__________(保留一位小数)
,其平衡常数表达式为 最终所得气体的平均相对分子质量为__________(保留一位小数) Ⅰ.(1)某兴趣小组甲设计了以下装置和方法测定空气中SO2含量。你认为可行的操作是 (填序号)
| 序号 | A | B | C |
| 装置 |  |  |  |
| 原理 | 通入V升空气,测定生成沉淀的质量 | 当KMnO4溶液刚好褪色时,测定通入空气的体积V | 通入V升空气,测定U型管增加的质量 |
(2)兴趣小组乙取336mL(标准状况)某由SO2和N2组成的混合气体Y,将其通入足量溴水中,然后加入足量BaCl2溶液,经适当操作后得干燥固体2.33g。由此推知气体Y中SO2的体积分数为 。
Ⅱ某化学兴趣小组丙为探究Fe3+是否能氧化SO2,设计了如下实验装置。

(1)如上图连接好装置。实验前应进行 操作
(2)观察到装置C中产生了白色沉淀,同学们提出了以下猜想(每个猜想只考虑一种物质的氧化性)。
猜想1: ;
猜想2:SO2被Fe3+氧化了;
猜想3:SO2被NO3—氧化了
(3)甲同学认为猜想1正确,并利用上述装置A进行了排除干扰的探究实验。
(4)乙同学认为猜想2正确,则装置C中反应的离子方程式是
(5)丙同学认为猜想3正确,他利用甲同学的实验装置,设计实验验证猜想。请在答题卡上写出实验步骤以及预期现象和结论。限选实验试剂:NaNO3溶液、KSCN溶液、FeCl3溶液、BaCl2溶液、
| 实验步骤 | 预期现象和结论 |
| | |
Fe(NO3)3溶液
实验室用乙醇和浓硫酸共热制取乙烯,常因温度过高而生成少量的二氧化硫,有人设计下列实验以确认上述混和气体中有乙烯和二氧化硫。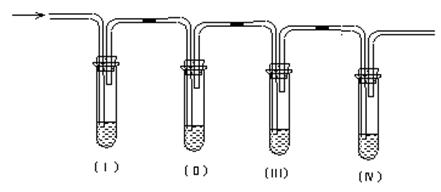
(1)Ⅰ、Ⅱ、Ⅲ、Ⅳ装置可盛放的试剂是:I ;II ;III ;IV (将下列有关试剂的序号填入空格内);
| A.品红溶液 | B.氢氧化钠溶液 | C.浓硫酸 | D.酸性高锰酸钾溶液 |
(3)使用装置Ⅱ的目的是 _________________________________________________ ;
(4)使用装置Ⅲ的目的是___________________________________________________;
(5)确证含有乙烯的现象是_________________________________________________。