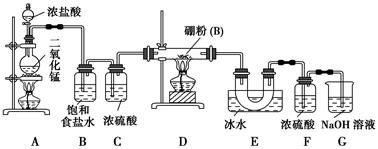
题目内容
某废液中含有大量的K+、Cl-、Br-,还有少量的Ca2+、Mg2+、SO42-。某研究性学习小组利用这种废液来制取较纯净的氯化钾晶体及液溴(Br2),设计了如下流程图: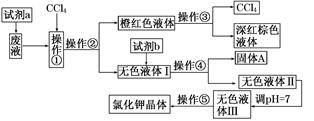
可供选择的试剂:饱和Na2CO3溶液,饱和K2CO3溶液、KOH溶液、BaCl2溶液、Ba(NO3)2溶液、H2O2溶液、KMnO4溶液(H+)、稀盐酸。
请根据流程图,回答相关问题:
(1)试剂a应该选用________。
(2)操作①②③④⑤的名称是________(填序号)。
| A.萃取、过滤、分液、过滤、蒸发结晶 |
| B.萃取、分液、蒸馏、过滤、蒸发结晶 |
| C.分液、萃取、过滤、过滤、蒸发结晶 |
| D.萃取、分液、分液、过滤、蒸发结晶 |
(4)调节pH的作用是________,操作方法是_____________________________________
________________________________________________________________________。
(5)操作⑤中用到的瓷质仪器名称是__________________________________________。
(1)H2O2溶液
(2)B
(3)BaCl2溶液、饱和K2CO3溶液、KOH溶液(或KOH溶液、BaCl2溶液、饱和K2CO3溶液或BaCl2溶液、KOH溶液、饱和K2CO3溶液)
(4)除去过量的OH-及CO32- 滴加稀盐酸,无气体产生时,用pH试纸测定至pH=7
(5)蒸发皿
解析

 口算能手系列答案
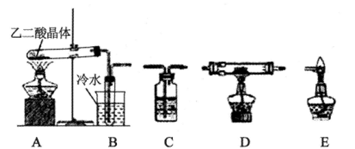
口算能手系列答案硫酸铜受热分解生成氧化铜和气体,加热温度不同,气体成分也不同。气体成分可能含SO2、SO3和O2中的一种、两种或三种。某化学课外活动小组通过设计探究性实验,测定反应产生的SO2、SO3和O2的物质的量,并计算确定各物质的化学计量数,从而确定CuSO4分解的化学方程式。实验用到的仪器如下图所示: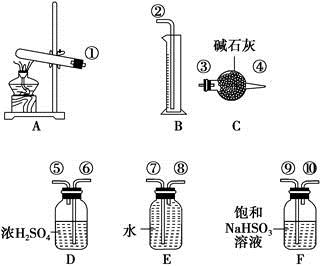
[提出猜想]
Ⅰ.所得气体的成分可能只含SO3一种;
Ⅱ.所得气体的成分可能含有 两种;
Ⅲ.所得气体的成分可能含有 三种。
[实验探究]
实验操作过程略。已知实验结束时,硫酸铜完全分解。
(1)请你组装探究实验的装置,按从左至右的方向,各仪器接口的连接顺序为①→⑨→⑩→⑥→⑤→ → → → →②(填接口序号)。
(2)若实验结束时B中量筒没有收集到水,则证明猜想 正确。
(3)有两个实验小组进行该实验,由于加热时的温度不同,实验结束后测得相关数据也不同,数据如下:
| 实验小组 | 称取CuSO4的质量/g | 装置C增加的质量/g | 量筒中水的体积折算成标准状况下气体的体积/mL |
| 一 | 6.4 | 2.56 | 448 |
| 二 | 6.4 | 2.56 | 224 |
请通过计算,推断出第一小组和第二小组的实验条件下CuSO4分解的化学方程式。
第一小组: ;
第二小组: 。
碘是人体必需的微量元素之一,有“智力元素”之称。食用加碘食盐可预防碘缺乏病。查阅资料知:
①在酸性条件下,I-能被N 氧化成I
氧化成I ,被H2O2或O2等氧化成I2;
,被H2O2或O2等氧化成I2;
②I 能被HS
能被HS 还原成I2。
还原成I2。
请你利用实验室常用仪器和下列限选试剂,依次研究某食盐样品中所加碘的存在形式是I2、I-、I 中的哪一种。
中的哪一种。
限选试剂如下:1.0 mol·L-1 HNO3溶液、1.0 mol·L-1 H2SO4溶液、1.0 mol·L-1 NaHSO3溶液、3% H2O2溶液、1%淀粉溶液、蒸馏水
Ⅰ.提出假设
假设1:该食盐样品中含I2;
假设2:该食盐样品中含I-;
假设3: 。
Ⅱ .设计方案与实验探究
将适量食盐样品溶于蒸馏水制成溶液,请按要求填写下表。
| 实验步骤 | 预期现象与结论 |
| 步骤1:取少量上述溶液注入试管中,滴入几滴淀粉溶液振荡 | 若溶液显 ,则假设1成立;否则,假设1不成立,再进行步骤2 |
| 步骤2: | 若溶液显蓝色,则假设2成立,反应的离子方程式为 ; 否则,假设2不成立,再进行步骤3 |
| 步骤3: | |
Ⅲ.问题与思考
纯的KIO3或KI都可以作为食用加碘盐中碘的来源。从化学角度来看,食盐中添加 (填“KIO3”或“KI”)更好;理由是 。
 BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。
BCl3↑+3H2↑;③硼与铝的性质相似,也能与氢氧化钠溶液反应。