题目内容
【题目】在80℃时,将0.40mol的N204气体充入2L已经抽空的固定容积的密闭容器中,发生如下反应:N2O42NO2 , 隔一段时间对该容器内的物质进行分析,得到如下数据:
时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
n(N2O4) | 0.40 | a | 0.20 | c | d | e |
n(NO2) | 0.00 | 0.24 | b | 0.52 | 0.60 | 0.60 |
(1)计算20s一40s内用N2O4表示的平均反应速率为molL﹣1S﹣1;
(2)计算在80℃时该反应的平衡常数K=(请注明单位).
(3)反应进行至100s后将反应混合物的温度降低,混合气体的颜色(填“变浅”.“变深”或“不变”)
(4)要增大该反应的K值,可采取的措施有(填序号):
A.增大N2O4的起始浓度
B.向混合气体中通入NO2
C.使用高效催化剂
D.升高温度
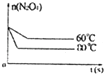
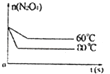
(5)如图是80℃时容器中N2O4物质的量的变化曲线,请在该图中补画出该反应在60℃时N2O4物质的量的变化曲线. 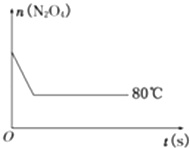
【答案】
(1)0.0020
(2)1.8mol?L﹣1
(3)变浅
(4)D
(5)解:当降低温度,化学反应速率减小,到达平衡所需时间增大,平衡向逆反应方向移动,所以到达新平衡时四氧化二氮的物质的量比第一次平衡时少,60℃曲线为.
故答案为:
【解析】解:(1)当20s时,生成二氧化氮0.24mol,则消耗四氧化二氮0.12mol,容器中还剩余0.40mol﹣0.12mol=0.28mol;v= ![]() =
= ![]() =0.0020mol/(L.s)
=0.0020mol/(L.s)
所以答案是:0.0020.(2)当到达80s时,二氧化氮的物质的量不再变化,所以反应达到平衡状态,二氧化氮的物质的量是0.60mol,则消耗四氧化二氮的物质的量是0.30mol,还剩余0.10mol,即d=e=0.10mol.
二氧化氮的平衡浓度= ![]() =0.30mol/L,四氧化二氮的平衡浓度=
=0.30mol/L,四氧化二氮的平衡浓度= ![]() =0.05mol/L
=0.05mol/L
K= ![]() =
= ![]() =1.8molL﹣1
=1.8molL﹣1
所以答案是:1.8molL﹣1 . (3)该反应的正反应是吸热反应,降低温度,平衡向逆反应方向移动,二氧化氮的含量减少,所以混合气体的颜色变浅.
所以答案是:变浅.(4)化学平衡常数只与温度有关,与其它任何物理量无关,故选D.
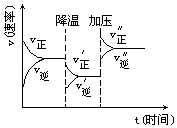
【考点精析】掌握化学平衡状态本质及特征和化学平衡的计算是解答本题的根本,需要知道化学平衡状态的特征:“等”即 V正=V逆>0;“动”即是动态平衡,平衡时反应仍在进行;“定”即反应混合物中各组分百分含量不变;“变”即条件改变,平衡被打破,并在新的条件下建立新的化学平衡;与途径无关,外界条件不变,可逆反应无论是从正反应开始,还是从逆反应开始,都可建立同一平衡状态(等效);反应物转化率=转化浓度÷起始浓度×100%=转化物质的量÷起始物质的量×100%;产品的产率=实际生成产物的物质的量÷理论上可得到产物的物质的量×100%.

 阅读快车系列答案
阅读快车系列答案