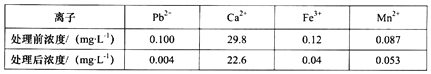
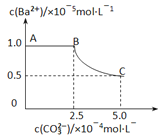
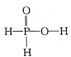
题目内容
【题目】黑火药是中国古代的四大发明之一,其爆炸的热化学方程式为:S(s)+2KNO3(s)+3C(s)=K2S(s)+N2(g)+3CO2(g) △H=xkJ·mol-l
已知:①C(s)+O2(g)=CO2(g) △H=akJ·mol-l
②K2S(s)=S(s)+2K(s) △H=bkJ·mol-l
③2K(s)+N2(g)+3O2(g)=2KNO3(s) △H=ckJ·mol-l
下列说法正确的是
A. x>0 a<0
B. b<0 c<0
C. x=3a-b-c
D. 1mol 碳(s)在空气中不完全燃烧生成CO的焓变小于akJ·mol-1
【答案】C
【解析】A项,黑火药爆炸为放热反应,x![]() 0,反应①为C(s)的燃烧反应,燃烧反应为放热反应,a
0,反应①为C(s)的燃烧反应,燃烧反应为放热反应,a![]() 0,错误;B项,反应②为分解反应,为吸热反应,b
0,错误;B项,反应②为分解反应,为吸热反应,b![]() 0,错误;C项,应用盖斯定律,①
0,错误;C项,应用盖斯定律,①![]() 3-②-③得黑火药爆炸的反应,则x=3a-b-c,正确;D项,1mol碳(s)不完全燃烧放出的热量小于完全燃烧放出的热量,燃烧反应的焓变小于0,则1mol碳(s)在空气中不完全燃烧生成CO的焓变大于akJ·mol-1,错误;答案选C。
3-②-③得黑火药爆炸的反应,则x=3a-b-c,正确;D项,1mol碳(s)不完全燃烧放出的热量小于完全燃烧放出的热量,燃烧反应的焓变小于0,则1mol碳(s)在空气中不完全燃烧生成CO的焓变大于akJ·mol-1,错误;答案选C。

练习册系列答案
相关题目