题目内容
【题目】碳及其化合物广泛存在于自然界。随着科技的进步,利用化学反应原理将含碳物质进行合理转化,已成为资源利用、环境保护等社会关注问题的焦点。如CO2是人类工业生产排放的主要的温室气体,利用CO2制造更高价值化学品是目前的研究热点。
(1)①利用CH4和CO2这两种温室气体可以生产水煤气。已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H =![]() 890.3 kJ·mol-1
890.3 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H =+2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H =![]() 566.0 kJ·mol-1
566.0 kJ·mol-1
反应CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g) 的△H =____kJ·mol-1
2CO(g)+2H2(g) 的△H =____kJ·mol-1
②250℃时,以镍合金为催化剂,向4 L恒容容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2 (g)+CH4(g) ![]() 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
此温度下该反应的平衡常数K=_______。
(2)利用CO2催化加氢可以合成乙醇,反应原理为:2CO2(g)+6H2(g) ![]() C2H5OH(g)+3H2O(g) H<0,设m为起始时的投料比,即m= n(H2)/ n(CO2)。
C2H5OH(g)+3H2O(g) H<0,设m为起始时的投料比,即m= n(H2)/ n(CO2)。
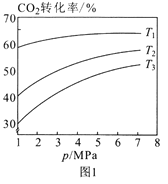
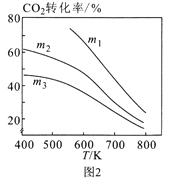
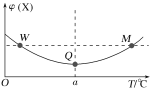
①图1中投料比相同,温度从高到低的顺序为____。
②图2中m1、m2、m3从大到小的顺序为____。
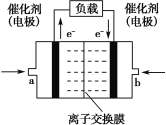
(3)高温电解技术能高效实现下列反应:CO2+H2O ![]() CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:
CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:
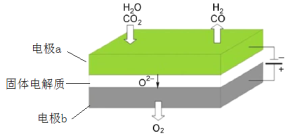
电极a的电极反应式____
(4)工业生产烟气中的CO2捕获技术之一是氨水溶液吸收技术,将烟气冷却至15.5℃~26.5℃后用氨水吸收过量的CO2。已知:NH3·H2O的Kb=1.7×10-5,H2CO3的Ka1=4.3×10-7、Ka2=5.6×10-11。吸收后所得溶液的pH____7(填“>”、“=”或“<”)。
【答案】+247.3 64 ![]()
![]() CO2+H2O + 4e- =CO+H2+2O2 - >
CO2+H2O + 4e- =CO+H2+2O2 - >
【解析】
(1)①根据盖斯定律得出答案;②先按照三段式建立关系,再列关系,解得答案。
(2)①图1中投料比相同,同压下,从下往上,转化率变大,分析评估移动;②当温度相同,从下往上,转化率升高,分析反应物的量对转化率的影响得出答案。
(3)A极化合价降低,发生还原反应,从而写出答案。
(4)用氨水吸收过量的CO2生成碳酸氢铵,根据NH3·H2O的电离平衡常数与H2CO3的Ka1平衡常数分析得出答案。
(1)(1)根据盖斯定律,第1个反应减第2个反应的2倍,再减第3个反应的2倍,得到反应CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g) 的△H =+247.3kJ·mol-1,故答案为:+247.3。
2CO(g)+2H2(g) 的△H =+247.3kJ·mol-1,故答案为:+247.3。
② CO2 (g) + CH4(g) ![]() 2CO(g) + 2H2(g)
2CO(g) + 2H2(g)
开始:6mol 6mol 0 0
转化:xmol xmol 2xmol 2xmol
平衡:(6-x)mol (6-x)mol 2xmol 2xmol
![]()
解得x = 4
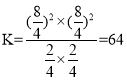 ,故答案为:64。
,故答案为:64。
(2)①图1中投料比相同,同压下,从下往上,转化率变大,平衡正向移动,减小温度,因此温度从高到低的顺序为T3 > T2 > T1,故答案为:T3 > T2 > T1。
②当温度相同,从下往上,转化率升高,则氢气量越来越大,即投料比m增大,因此图2中m1、m2、m3从大到小的顺序为m1 > m2 > m3,故答案为:m1 > m2 > m3。
(3)A极化合价降低,发生还原反应,因此电极a的电极反应式CO2+H2O +4e-= CO+H2+ 2O2-,故答案为:CO2+H2O +4e-= CO+H2+ 2O2-。
(4)用氨水吸收过量的CO2生成碳酸氢铵,由于NH3·H2O的Kb=1.7×10-5大于H2CO3的Ka1=4.3×10-7,因此吸收后所得溶液的pH > 7,故答案为:>。

【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构、熔点/℃角度分析,原因是______________。
(2)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因____________。
GeCl4 | GeBr4 | Gel4 | |
熔点/℃ | -49.5 | 26 | 146 |
沸点/℃ | 83.1 | 186 | 约400 |
(3)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是______________。
(4)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为__________,微粒之间存在的作用力是________。
(5)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置。如图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(![]() ,0,
,0,![]() );C(
);C(![]() ,0,
,0,![]() ),则D原子的坐标参数为_________。
),则D原子的坐标参数为_________。
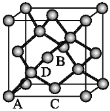
②晶胞参数:描述晶胞的大小和形状。已知Ge单晶的晶胞参数a=565.76 pm,其密度为_______ g·cm3(列出计算式即可)。
【题目】弱电解质在水溶液中的电离状况可以进行定量计算和推测。
(1)25℃时两种酸的电离平衡常数如表所示。
Ka1 | Ka2 | |
HA | 1×10-4 | |
H2B | 1×10-2 | 5×10-6 |
①25℃时,0.100mol·L-1的NaA溶液中H+、OH-、Na+、A-、HA的物质的量浓度由大到小的顺序是:___。pH=8的NaA溶液中由水电离出的c(OH-)=___mol·L-1。
②25℃时,0.100mol·L-1的NaHB溶液pH___7,理由是___。
③25℃时,向0.100mol·L-1的Na2B溶液中滴加足量0.100mol·L-1的HA溶液,反应的离子方程式为___。
(2)已知25℃时,向0.100mol·L-1的H3PO4溶液中滴加NaOH溶液,各含磷微粒的物质的量分数随pH变化的关系如图所示。
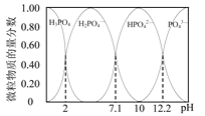
①当溶液pH由11到14时,所发生反应的离子方程式为:___。