题目内容
【题目】75%的乙醇即医用酒精,因为杀灭病毒效果好且价格相对便宜,在生活中被大量使用。工业上主要用乙烯和水蒸气直接化合法制备乙醇。
回答下列问题:
(1)已知:
①2C2H6(g)+ O2(g)![]() 2C2H4(g)+ 2H2O(g) ΔH1=-192 kJ/mol
2C2H4(g)+ 2H2O(g) ΔH1=-192 kJ/mol
②2H2(g)+ O2(g)![]() 2H2O(g) ΔH2=-484 kJ/mol
2H2O(g) ΔH2=-484 kJ/mol
则③C2H6(g)![]() C2H4(g) + H2(g) ΔH3=__________kJ/mol
C2H4(g) + H2(g) ΔH3=__________kJ/mol
(2)某温度下,一定量的乙烷在刚性容器内发生反应③,起始浓度为 c0,平衡时容器内总压强增加了 20%,乙烷的转化率为_____,该温度下反应的平衡常数 K=__用含 c0 的式子表示)。
(3)气相直接水合法制取乙醇的反应④:H2O(g)+C2H4(g)![]() CH3CH2OH(g) ΔH4。恒压下,当起始 n(H2O)︰n(C2H4)=1︰1 时,催化反应相同时间,测得不同温度下 C2H4 转化为 CH3CH2OH 的转化率如下图所示。(图中虚线表示相同条件下C2H4的平衡转化率随温度的变化)
CH3CH2OH(g) ΔH4。恒压下,当起始 n(H2O)︰n(C2H4)=1︰1 时,催化反应相同时间,测得不同温度下 C2H4 转化为 CH3CH2OH 的转化率如下图所示。(图中虚线表示相同条件下C2H4的平衡转化率随温度的变化)

①分析图像可知ΔH4_____0(填“>”或“<”),理由是_______。
②X 点,v正_________v逆(填“>””“<”或“=”)。在 X 点的条件下,进一步提高 C2H4 转化率的方法是_______(写一种)。
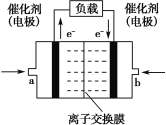
(4)乙醇可用于制备各种燃料电池。下图是乙醇碱性燃料电池的结构示意图,使用的离子交换膜是_____(填“阳离子”或“阴离子”)交换膜,a 侧的电极反应式是_______。
【答案】+146 20%或者 0.2 0.05 c0 < 温度升高,C2H4 平衡转化率减小,平衡逆向移动,该反应为放热反应 > 延长反应时间或及时分离出产品 阴离子 C2H5OH-12e-+16OH- = 2CO32-+11H2O
【解析】
(1)已知:
①2C2H6(g)+ O2(g)![]() 2C2H4(g)+ 2H2O(g) ΔH1=-192 kJ/mol
2C2H4(g)+ 2H2O(g) ΔH1=-192 kJ/mol
②2H2(g)+ O2(g)![]() 2H2O(g) ΔH2=-484 kJ/mol
2H2O(g) ΔH2=-484 kJ/mol
利用盖斯定律,将[①-②]×![]() ,即得:③C2H6(g)
,即得:③C2H6(g)![]() C2H4(g) + H2(g)的ΔH3。
C2H4(g) + H2(g)的ΔH3。
(2)可设乙烷的转化率为x,利用三段式得出各物质的平衡量,从而建立反应前后的压强关系式,利用“平衡时容器内总压强增加了 20%”,求乙烷的转化率及该温度下反应的平衡常数 K。
(3)①从图象中可看出,升高温度,C2H4的转化率减小,则平衡逆向移动,从而得出ΔH4与0的关系。
②X 点之后,平衡继续正向移动,由此可确定v正与v逆的关系。在 X 点的条件下,可延长时间或分离产物,进一步提高 C2H4 转化率。
(4)左侧电极失电子,则加入的是乙醇,右侧电极获得电子,则通入氧气,由电极反应式,可确定离子交换膜的类型。
(1)已知:
①2C2H6(g)+ O2(g)![]() 2C2H4(g)+ 2H2O(g) ΔH1=-192 kJ/mol
2C2H4(g)+ 2H2O(g) ΔH1=-192 kJ/mol
②2H2(g)+ O2(g)![]() 2H2O(g) ΔH2=-484 kJ/mol
2H2O(g) ΔH2=-484 kJ/mol
利用盖斯定律,将[①-②]×![]() ,即得:③C2H6(g)
,即得:③C2H6(g)![]() C2H4(g) + H2(g)的ΔH3=+146 kJ/mol。答案为:+146;
C2H4(g) + H2(g)的ΔH3=+146 kJ/mol。答案为:+146;
(2) 设乙烷的转化率为x,则三段式为:
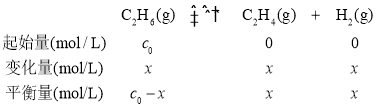
![]() ,x=0.2c0,乙烷的转化率为
,x=0.2c0,乙烷的转化率为![]() =20%;该温度下反应的平衡常数 K=
=20%;该温度下反应的平衡常数 K=![]() = 0.05 c0 。答案为:20%或者 0.2;0.05 c0;
= 0.05 c0 。答案为:20%或者 0.2;0.05 c0;
(3)①从图象中可看出,升高温度,C2H4的转化率减小,则平衡逆向移动,从而得出ΔH4< 0,理由是温度升高,C2H4 平衡转化率减小,平衡逆向移动,该反应为放热反应。答案为:<;温度升高,C2H4 平衡转化率减小,平衡逆向移动,该反应为放热反应;
②X 点之后,平衡继续正向移动,则X 点未达平衡,v正>v逆。在 X 点的条件下,进一步提高 C2H4span> 转化率的方法是延长反应时间或及时分离出产品。答案为:>;延长反应时间或及时分离出产品;
(4)左侧电极失电子,则加入的是乙醇,发生反应C2H5OH-12e-+16OH- = 2CO32-+11H2O;右侧电极获得电子,则通入氧气,电极反应为3O2+12e-+6H2O=12OH-,从电极反应式可以看出,左侧消耗OH-,右侧生成OH-,所以使用的离子交换膜是阴离子交换膜,a 侧的电极反应式是C2H5OH-12e-+16OH- = 2CO32-+11H2O。答案为:阴离子;C2H5OH-12e-+16OH- = 2CO32-+11H2O。

 小学期末标准试卷系列答案
小学期末标准试卷系列答案【题目】已知25℃时部分弱电解质的电离平衡常数数据如表所示,回答下列问题:
化学式 | CH3COOH | H2CO3 | HClO |
电离平衡常数 | Ka=1.8×10﹣5 | Ka1=4.3×10﹣7 Ka2=5.6×10﹣11 | Ka=3.0×10﹣8 |
(1)物质的量浓度均为0.1molL﹣1的四种溶液:pH由小到大排列的顺序是_______(用编号填写)
a.CH3COONa b.Na2CO3 c.NaClO d.NaHCO3
(2)常温下,0.1molL﹣1 CH3COOH溶液加水稀释过程中,下列表达式的数据变大的是_____(填字母)_______
A. c(H+) B.![]() C. c(H+)c(OH﹣) D.
C. c(H+)c(OH﹣) D. ![]() E.
E. ![]()
(3)写出向次氯酸钠溶液中通入少量二氧化碳的离子方程式:__________________
(4)25℃时,CH3COOH与CH3COONa的混合溶液,若测得混合液pH=6,则溶液中
c(CH3COO﹣)﹣c(Na+)=________(填准确数值)。
(5)25℃时,将a molL﹣1的醋酸与b molL﹣1氢氧化钠等体积混合,反应后溶液恰好显中性,用a、b表示醋酸的电离平衡常数为____________________________________
(6)标准状况下,将1.12L CO2通入100mL 1molL﹣1的NaOH溶液中,用溶液中微粒的浓度符号完成下列等式: c(OH﹣)=2c(H2CO3)+_________________________
【题目】碳及其化合物广泛存在于自然界。随着科技的进步,利用化学反应原理将含碳物质进行合理转化,已成为资源利用、环境保护等社会关注问题的焦点。如CO2是人类工业生产排放的主要的温室气体,利用CO2制造更高价值化学品是目前的研究热点。
(1)①利用CH4和CO2这两种温室气体可以生产水煤气。已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H =![]() 890.3 kJ·mol-1
890.3 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H =+2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H =![]() 566.0 kJ·mol-1
566.0 kJ·mol-1
反应CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g) 的△H =____kJ·mol-1
2CO(g)+2H2(g) 的△H =____kJ·mol-1
②250℃时,以镍合金为催化剂,向4 L恒容容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2 (g)+CH4(g) ![]() 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
此温度下该反应的平衡常数K=_______。
(2)利用CO2催化加氢可以合成乙醇,反应原理为:2CO2(g)+6H2(g) ![]() C2H5OH(g)+3H2O(g) H<0,设m为起始时的投料比,即m= n(H2)/ n(CO2)。
C2H5OH(g)+3H2O(g) H<0,设m为起始时的投料比,即m= n(H2)/ n(CO2)。
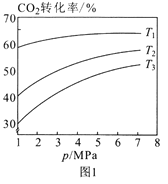
①图1中投料比相同,温度从高到低的顺序为____。
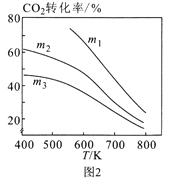
②图2中m1、m2、m3从大到小的顺序为____。
(3)高温电解技术能高效实现下列反应:CO2+H2O ![]() CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:
CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:
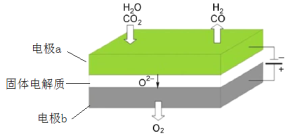
电极a的电极反应式____
(4)工业生产烟气中的CO2捕获技术之一是氨水溶液吸收技术,将烟气冷却至15.5℃~26.5℃后用氨水吸收过量的CO2。已知:NH3·H2O的Kb=1.7×10-5,H2CO3的Ka1=4.3×10-7、Ka2=5.6×10-11。吸收后所得溶液的pH____7(填“>”、“=”或“<”)。
【题目】四氯化锡(SnCl4)常用作有机催化剂、烟雾弹和用来镀锡。某学习小组拟用干燥的氯气和熔融的锡制备 SnCl4 并测定产品的纯度。

已知:i.SnCl4 在空气中极易水解成 SnO2·xH2O;ii.有关物质的物理性质如下表所示。
物质 | 颜色 | 熔点/℃ | 沸点/℃ |
Sn | 银白色 | 232 | 2260 |
SnCl2 | 白色 | 247 | 652 |
SnCl4 | 无色 | -33 | 114 |
回答下列问题:
(1)装置 E 的仪器名称是_____,装置 C 中盛放的试剂是_____。
(2)装置 G 的作用是_____。
(3)实验开始时,正确的操作顺序为_____。
①点燃装置 A 处酒精灯 ②点燃装置 D 处酒精灯 ③打开分液漏斗活塞
(4)得到的产品显黄色是因含有少量_____,可以向其中加入单质___________(填物质名称)而除去。为了进一步分离提纯产品,采取的操作名称是_____。
(5)产品中含少量 SnCl2,测定产品纯度的方法:取 0.400 g 产品溶于足量稀盐酸中,加入淀粉溶液作指示剂,用 0.0100 mo/L 碘酸钾标准溶液滴定至终点,消耗标准液 8.00 mL 。
①滴定原理如下,完成 i 对应的离子方程式。
i._____Sn2++_____IO3-+_____H+= ________Sn4++_____I-+_____
ii.IO3-+5 I2-+6H+ = 3I2 + 3HO
②滴定终点的现象是_____。
③产品的纯度为_____%(保留一位小数)。