题目内容
【题目】在相同温度下,0.01mol/L的NaOH溶液和0.01mol/L的盐酸相比较,下列说法正确的是( )
A.两溶液的pH之和等于14
B.由水电离出的c(H+)都是1.0×10-12mol/L
C.由水电离出的c(OH-)相等
D.若将0.01mol/L的盐酸换成同浓度的醋酸,对水的电离的影响不变
【答案】C
【解析】
A.温度未知,不同温度下水的离子积常数不同,两溶液的pH之和不一定等于14,故A错误;
B.温度未知,虽然二者对水的电离抑制效果相同,但不同温度下水的离子积常数不同,计算出的水电离出的氢离子浓度不都是1.0×10-12mol/L,故B错误;
C.0.01mol/L NaOH溶液中水电离出的c(H+)水=![]() mol/L,0.01mol/L的盐酸溶液中水电离出的c(H+)水=c(OH-)水=
mol/L,0.01mol/L的盐酸溶液中水电离出的c(H+)水=c(OH-)水=![]() mol/L,所以由水电离出的c(H+)相等,故C正确;
mol/L,所以由水电离出的c(H+)相等,故C正确;
D.醋酸为弱酸,0.01mol/L的醋酸电离出的氢离子要比盐酸少,对水的电离抑制作用较弱,故D错误;
故答案为C。

 名题金卷系列答案
名题金卷系列答案 优加精卷系列答案
优加精卷系列答案【题目】碳及其化合物广泛存在于自然界。随着科技的进步,利用化学反应原理将含碳物质进行合理转化,已成为资源利用、环境保护等社会关注问题的焦点。如CO2是人类工业生产排放的主要的温室气体,利用CO2制造更高价值化学品是目前的研究热点。
(1)①利用CH4和CO2这两种温室气体可以生产水煤气。已知:CH4(g)+2O2(g)=CO2(g)+2H2O(g) △H =![]() 890.3 kJ·mol-1
890.3 kJ·mol-1
CO(g)+H2O (g)=CO2(g)+H2 (g) △H =+2.8 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) △H =![]() 566.0 kJ·mol-1
566.0 kJ·mol-1
反应CO2(g)+CH4(g) ![]() 2CO(g)+2H2(g) 的△H =____kJ·mol-1
2CO(g)+2H2(g) 的△H =____kJ·mol-1
②250℃时,以镍合金为催化剂,向4 L恒容容器中通入6 mol CO2、6 mol CH4,发生如下反应:CO2 (g)+CH4(g) ![]() 2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
2CO(g)+2H2(g)。平衡体系中各组分体积分数如下表:
物质 | CH4 | CO2 | CO | H2 |
体积分数 | 0.1 | 0.1 | 0.4 | 0.4 |
此温度下该反应的平衡常数K=_______。
(2)利用CO2催化加氢可以合成乙醇,反应原理为:2CO2(g)+6H2(g) ![]() C2H5OH(g)+3H2O(g) H<0,设m为起始时的投料比,即m= n(H2)/ n(CO2)。
C2H5OH(g)+3H2O(g) H<0,设m为起始时的投料比,即m= n(H2)/ n(CO2)。
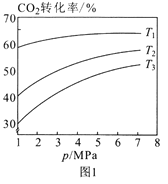
①图1中投料比相同,温度从高到低的顺序为____。
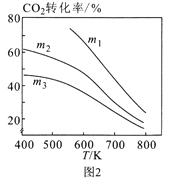
②图2中m1、m2、m3从大到小的顺序为____。
(3)高温电解技术能高效实现下列反应:CO2+H2O ![]() CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:
CO+H2+O2,其可将释放的CO2转化为具有工业利用价值的产品。工作原理示意图如下:
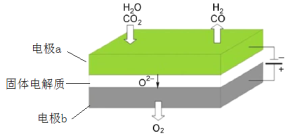
电极a的电极反应式____
(4)工业生产烟气中的CO2捕获技术之一是氨水溶液吸收技术,将烟气冷却至15.5℃~26.5℃后用氨水吸收过量的CO2。已知:NH3·H2O的Kb=1.7×10-5,H2CO3的Ka1=4.3×10-7、Ka2=5.6×10-11。吸收后所得溶液的pH____7(填“>”、“=”或“<”)。